微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 两种微粒的质子数和电子数均分别相等,它们不可能是
A.一种阳离子和一种阴离子
B.一种单质和一种化合物分子
C.一种分子和一种离子
D.一种原子和一种分子
参考答案:C
本题解析:略
本题难度:简单
2、简答题 (14分)现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素。X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5。
(1)R元素在周期表中的位置?;W2X2的电子式?。
(2)X、Y、Z的最低价氢化物中:沸点最高的是?(填化学式);共价键键能最小的是?;X、Y、Z的杂化类型?(填相同或不相同)。
(3)若R的晶体中每个晶胞平均含有2个R原子,请在下图晶胞中用?标出未画出的R原子。
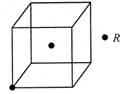
(4)将1.19g ZXY2溶于100ml水中发生非氧化还原反应,生成2种酸,反应方程式为?;所得溶液中阴离子浓度由大到小的顺序是?。
参考答案:(14分)
(1)第四周期VIIB (2分)
(2)H2O(1分) H2S(1分) ?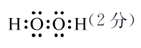 ?相同(2分)
?相同(2分)
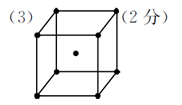
(4)SOCl2+2H2O=2HCl+H2SO3(2分)
c(Cl?) > c(HSO3?) > c(SO32?) > c(OH?) (2分)
本题解析:X原子的最外层电子数是核外电子层数的3倍,则X为O元素;X、Z同主族,且为短周期元素,则Z为S元素;Y的最高正价与最低负价的代数和为6,则Y为Cl元素;W与X、Y均不同周期,W为H元素;R2+的价电子排布式为3d5,故R为Mn元素。
(1)R为Mn元素,原子序数为25,在周期表中位于第四周期VIIB;W2X2为H2O2电子式为: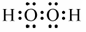
(2)X、Y、Z的最低价氢化物分别为H2O、HCl、H2S,因为H2O分子间能形成氢键,作用力更强,所以H2O的沸点最高;O、Cl、S元素非金属性最弱的是S元素,所以H2S共价键键能最小;O、Cl、S的杂化类型都是sp3杂化,杂化类型相同。
(3)每个晶胞平均含有2个R原子,图中已标出的原子位于体心,则未标出的R原子应在立方体的8个顶点上。
(4)ZXY2为SOCl2与水发生非氧化还原反应,生成2种酸为HCl和H2SO3,所以化学方程式为:SOCl2+2H2O=2HCl+H2SO3;H2SO3为中强酸,第一步电离大于第二步电离,所以阴离子浓度由大到小的顺序是:c(Cl?) > c(HSO3?) > c(SO32?) > c(OH?)
本题难度:一般
3、选择题 下列性质的递变中,正确的是
A.O、Na、S的原子半径依次增大
B.LiOH、KOH、CsOH的碱性依次增强
C.HF、NH3、SiH4的稳定性依次增强
D.HCl、HBr、HI的还原性依次减弱
参考答案:B
本题解析:A.对于电子层数相同的微粒来说,原子序数越大,原子半径越小。因此Na>S;对于电子层数不同的元素来说,原子核外电子层数越多,原子半径就越大,所以S>O。因此原子半径大小关系是:Na>S>O。错误。B.元素的金属性:Li<K<Cs.元素的金属性越强,其对应的最高价氧化物的水化物的碱性就越强,因此减小LiOH < KOH <CsOH。正确。C.元素的非金属性F>N>Si。元素的非金属性越强,其对应的简单的氢化物的稳定性就越强,因此稳定性:HF>NH3>SiH4。错误。D.元素的非金属性越强,其对应的简单氢化物的还原性就越弱。由于非金属性:Cl>Br>I。所以还原性:HI> HBr> HCl。错误。
本题难度:简单
4、选择题 运用元素周期律分析下面的推断,其中错误的是
A.砹(At)为有色固体,HAt不稳定
B.铊(T1)是铝的同族元素,原子核外有6个电子层,推测T1(OH)3是两性氢氧化物
C.已知锶Sr与镁同族且原子半径大于钙,硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)比硫化氢稳定性差
参考答案:B
本题解析:A正确,卤素单质从上到下,颜色逐渐加深;由于氢化物的稳定性与元素的非金属性有关,非金属性越强氢化物越稳定;
B错,铝为第IIIA族元素,同主族元素从上到下元素的金属性增强,T1(OH)3不可能是两性氢氧化物;
C正确,对于第IIA族元素的硫酸盐来说,如硫酸镁溶于水,硫酸钙微溶于水,硫酸钡难溶于水,可推测硫酸锶(SrSO4)是难溶于水的白色固体;
D正确,硒与硫为同主族元素,且硒位于硫的下方,非金属性比硫弱,氢化物的稳定性比硫弱;
本题难度:一般
5、填空题 下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用相应化学用语回答下列问题:
族周期
| IA
| ?
| 0
|
1
| ①
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| ?
|
2
| ?
| ?
| ?
| ②
| ③
| ④
| ?
| ?
|
3
| ⑤
| ?
| ⑥
| ⑦
| ?
| ⑧
| ⑨
| ?
|
(1)画出表中形成化合物种类最多元素的原子结构示意图?;写出它与原子半径最小的原子形成10电子且为正四面体结构的化合物的电子式_________,用电子式表示⑤和⑧形成化合物的过程________________________________________。
(2)④⑤⑧形成的简单离子半径由大到小的顺序为_______________(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为____(填化学式)。
(3)⑤和⑨形成化合物的晶体类型为__________。
(4)这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是___________(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式__________。
(5)X、Y由①②④中的两种或三种元素组成。X的溶液能与小苏打反应产生Y,若X是其所属系列中最简单的分子,且相对分子质量为46,则X的名称为?,写出X溶液与小苏打反应的化学方程式为_______________。
参考答案:(1) (1分);
(1分);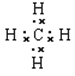 (1分);
(1分);
 (1分);
(1分);
(2)S2->O2->Na+(1分);HClO4>HNO3>H2SiO3(1分)?(3)离子晶体(1分)
(4)Al2O3(1分) ;Al2O3+2OH-=2AlO- 2+H2O(2分)
(5)甲酸(1分);HCOOH+NaHCO3= HCOONa +CO2↑+H2O(2分)
本题解析:根据元素①~⑨在表中的位置可知,它们分别是H、C、N、O、Na、Al、Si、S、Cl。
(1)形成化合物种类最多元素是碳元素,碳元素的原子序数是6,其原子结构示意图为 ;原子半径最小的是氢元素,因此它与原子半径最小的原子形成10电子且为正四面体结构的化合物是甲烷,其电子式为
;原子半径最小的是氢元素,因此它与原子半径最小的原子形成10电子且为正四面体结构的化合物是甲烷,其电子式为 ;⑤和⑧形成化合物是硫化钠,含有离子键的离子化合物,其形成过程可表示为
;⑤和⑧形成化合物是硫化钠,含有离子键的离子化合物,其形成过程可表示为 。
。
(2)④⑤⑧形成的简单离子分别是O2-、Na+、S2-,离子的核外电子层数越多离子半径越大。核外电子排布相同的微粒其离子半径随原子序数的增大而减小,所以④⑤⑧形成的简单离子半径由大到小的顺序是S2->O2->Na+。非金属性越强,最高价氧化物对应水化物的酸性越强,③⑦⑨三种元素的非金属性强弱顺序是Cl>N>Si,其最高价氧化物对应水化物的酸性由强到弱的顺序为HClO4>HNO3>H2SiO3。
(3)⑤和⑨形成化合物是NaCl,其晶体类型为离子晶体。
(4)不溶于水,但既能与强酸又能与强碱反应的是Al2O3。钠的最高价氧化物对应水化物是氢氧化钠,和氧化铝反应的离子方程式为Al2O3+2OH-=2AlO- 2+H2O。
(5)X的溶液能与小苏打反应产生Y,这说明X的酸性强于碳酸的。又因为X是由H、C、O元组成,如果X是其所属系列中最简单的分子,且相对分子质量为46,则X一定是甲酸,与碳酸氢纳反应的化学方程式为HCOOH+NaHCO3= HCOONa +CO2↑+H2O。
本题难度:一般