|
高中化学知识点归纳《物质制备实验方案的设计》高频考点巩固(2017年模拟版)(八)
2017-07-18 02:55:47
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
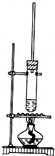
1、选择题 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图.下列对该实验的描述错误的是( )
A.不能用水浴加热
B.长玻璃管有冷凝回流作用
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D.加入过量乙酸可以提高1-丁醇的转化率
| 
参考答案:C
本题解析:
本题难度:简单
2、实验题 硬铝废料(含90%铝、2.5%镁和7.5%铜)可制取明矾 KAl(SO4)2·12H2O,某探究小组设计了下列实验。?

请回答以下问题:
(1)写出步骤②的离子方程式___________;简述用pH试纸测定溶液 pH的过程:_____________。
(2)步骤④包括三个操作环节,分别是___________、_____________、_____________。
(3)步骤⑤不直接用水洗的原因是_________________,洗涤的操作是___________。
(4)有人建议:直接将硬铝溶于稀H2SO4中,过滤:滤液中加适量K2SO4得到溶液丙,再进行后续实验。请你评价此建议的可行性_____________。
参考答案:(1)AlO2-+H++H2O=Al(OH)3↓ 或Al(OH)4-+H+=Al(OH)3↓+H2O? ;用洁净的玻璃棒沾取溶液滴到pH试纸上,待变色后,与比色卡对照,读出pH
(2)加热浓缩 ;冷却结晶 ;过滤
(3)减少产品的损失(或“减少晶体的溶解”或“明矾 在酒精中的溶解度小”等) ;往漏斗中加入洗涤剂 至浸没固体,自然流出,重复2~3次
(4)不可行 ,因为按此方法获得的溶液中还含有 Mg2+ ,最后得到的产品不纯
本题解析:
本题难度:一般
3、选择题 用含少量镁的铝片制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是
[? ]
①加盐酸溶解 ②加烧碱溶液溶解 ③过滤 ④通入过量 CO2生成Al(OH)3沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液生成Al(OH)3沉淀
A.①⑤⑥③
B.②③⑥③
C.②③④③
D.②③⑤③
参考答案:C
本题解析:
本题难度:一般
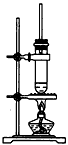
4、选择题 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125℃,反应装置如图。下列对该实验的描述错误的是
[? ]
A.不能用水浴加热
B.长玻璃管起冷凝回流作用
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D.加入过量乙酸可以提高1-丁醇的转化率
参考答案:C
本题解析:
本题难度:一般
5、简答题 硫酸亚铁是一种重要的食品和饲料添加剂,某课外兴趣小组在实验室用废铁屑与稀硫酸在加热条件下制取FeSO4?X?H2O,并测定该晶体中结晶水含量.请回答下列问题:
(1)铁屑表面少量的铁锈(主要成分为Fe2O3?a?H2O?)对制取硫酸亚铁有无影响______(填“有”或“无”.其原因是______,该步实验的关键是保证______过量(填“硫酸”或“铁屑”);
(2)FeSO4在不同温度下溶解度如下表所示:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80
溶解度/g/100g水
18.5
20.8
26.3
32.8
40.1
48.4
52.4
50.9
43.7
|
由于铁屑中含有C、Si等杂质,为了使FeSO4?溶液的浓度增大,便于反应后分离溶液和残渣.该小组实验时采取了水浴加热和趁热过滤的方法,这样做的主要目的是为了防止______.你认为实验时的水浴温度最好控制在______℃左右.从滤液中获得FeSO4?xH2O,下列操作中不需要的是______;
(A)冷却?(B)蒸发
(C)结晶?(D)洗涤?(E)过滤
(3)以下是测定FeSO4?xH2O中结晶水含量的实验流程.(称量仪器为电子天平)
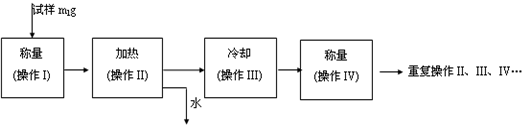
①其加热装置正确的是______
②重复操作II、III、IV,直到连续两次称量结果相差不超过______g;
③操作III必须要在______中(填仪器名称)进行.
(4)以下结晶水含量测定操作正确的是______;
A、加热时,晶体溅出坩埚,再加些FeSO4?xH2O
B、加热时,先用小火,后用大火加热至最后
C、加热时,不断用玻璃棒搅拌
D、恒重操作是指加热、冷却、称量这一过程重复两次
(5)实验中出现下列情况时,将对X值有何影响(填“偏大”、“偏小”或“无影响”):灼烧时有黑色固体出现______;在冷却过程中,无水硫酸亚铁又吸收了空气中的水蒸气______.
参考答案:(1)少量的铁锈和铁屑反应生成二价铁离子,所以对制取硫酸亚铁无影响,但必须是铁屑过量,保证溶液中三价铁离子完全转化为二价铁离子,
故答案为:无;生成的少量Fe3+?与铁屑反应转化为Fe2+;铁屑;
(2)根据图表分析知,0~60℃,温度越高硫酸亚铁的溶解性越大;60~80℃,温度越高溶解度反而减小;所以采取了水浴加热和趁热过滤的方法防止硫酸亚铁晶体析出;60℃时硫酸亚铁的溶解度最大,所以实验时的水浴温度最好控制在60℃左右;从滤液中获取硫酸亚铁晶体不需要蒸发,故选B.
故答案为:硫酸亚铁晶体析出;60℃;B;?
?(3)①测定FeSO4?xH2O中结晶水含量的实验中必须在坩埚中加热,装置应选C,故答案为:C;
②重复操作II、III、IV,直到连续两次称量结果相差不超过0.001g,故答案为:0.001;
③为防止空气中的物质和其反应,所以应在干燥器中冷却,故答案为:干燥器;?
(4)A、加热时,晶体溅出坩埚,应重新做实验,故A错误;
B、加热时,先用小火,后用大火加热,至恒重,故B错误;
C、加热时,不断用玻璃棒搅拌,防止局部受热造成液体飞溅,故C正确;
D、恒重操作是指两次称重之差不大于0.0003g,故D错误;
故答案为:C;
(5)灼烧时有黑色固体出现,说明硫酸亚铁分解生成气体,所以m(H2O)偏大;在冷却过程中,无水硫酸亚铁又吸收了空气中的水蒸气,则结晶水合物中m(H2O)偏小,
故答案为:偏大;偏小.
本题解析:
本题难度:一般
| 

