微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 已知:碱金属或碱土金属(Ⅱ族)与H2在隔绝空气加热时要以发生反应,生成离子型金属氢化物,如
NaH、CaH2等,它们易与水反应。现有甲、乙两位同学分别设计了制备CaH2的实验,装置如图所示(分别以序号Ⅰ、Ⅱ表示),铁架台等夹持固定仪器已略去。
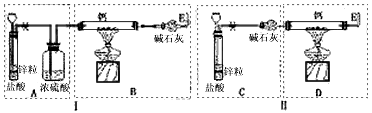
请回答下列问题
(1)锌与盐酸反应的离子方程式为__________________________;
(2)最后实验结果显示,两位同学的实验装置设计都有缺陷。装置Ⅰ的不足之处是________________,装置Ⅱ的不足之处是__________________________;
(3)请你从两套装置中选取你认为合理的部分,按从左到右的顺序组装一套制取CaH2的合理装置(用序号A、B、C……表示)_______________________;
(4)检查完装置的气密性后,为了保证产品的纯度和实验安全必须先_________________,然后再____________________,才能点燃酒精灯加热。同样,为了安全,反应开始后,在E口处应_______________;
(5)军事和气象野外作业常用CaH2做生氢剂,使之与水反应产生H2,其反应的化学方程式为_____________________________。
参考答案:(1)Zn+2H+=Zn2++H2↑
(2)制H2装置后缺少除HCl气体的装置;制CaH2装置后缺少干燥装置
(3)C、B
(4)通氢气;检验氢气纯度至达标;点燃尾气(或外接气体等)
(5)CaH2+2H2O=Ca(OH)2+2H2↑
本题解析:
本题难度:困难
2、实验题 淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去)
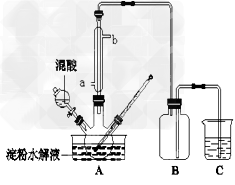
实验过程如下:
①将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30?min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的目的是:_____________________。
(2)冷凝水的进口是________(填a或b);实验中若混酸滴加过快,将导致草酸产量下降,其原因是______________________。
(3)检验淀粉是否水解完全所用的试剂为____________________。
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有________________________。
(5)当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NOx全部吸收,发生的化学反应为:NO2+NO+2NaOH=2NaNO2+H2O,若用含硫酸的母液来吸收氮氧化物,其优点是
___________、缺点是____________。
(6)?将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4-?+?5H2C2O4?+?6H+?=?2Mn2+?+?10CO2↑+?8H2O 称取该样品0.12?g,加适量水完全溶解,然后用0.020?mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色由_______变为________。滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为__________________。

参考答案:(1) 加快淀粉水解的速度(或起到催化剂的作用)
(2) a;温度过高 、硝酸浓度过大,导致H2C2O4进一步被氧化?
(3) 碘水或KI-I2溶液?
(4) 布氏漏斗、吸滤瓶 (安全瓶、抽气泵不作为主要仪器)?
(5) 优点:提高HNO3利用率(或循环使用氮氧化物);缺点:NOx(或氮氧化物)吸收不完全
(6)无色;紫红色(或淡紫色);84.0%
本题解析:
本题难度:一般
3、实验题 某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用其产物进一步制取FeCl3·6H2O晶体(图中夹持及尾气处理装置均已略去)。

(1)装置B中发生反应的化学方程式为____ 。
(2)装置E中的现象是____ 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,将滤液分成两份,分别检验滤液中的金属阳离子。检验Fe3+所用的试剂为___ 检验Fe2+所用的试剂为___。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下
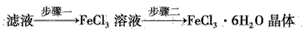
①步骤一中通入足量Cl2发生反应的离子方程式为___。
②步骤二从FeCl3溶液中得到FeCl3·6H2O晶体的主要操作如下(均在HCl气氛中进行): 蒸发、浓缩→冷却、结晶→过滤、洗涤、干燥 在蒸发皿中进行蒸发、浓缩操作时,当____时,应停止加热。此过程应保持盐酸过量的原因是___(用离子方程式表示)。
(5) FeCl3溶液可用于天然气脱硫,写出FeCl3溶液与天然气中的H2S反应的离子方程式:____。
参考答案:(1)3Fe +4H2O(g) Fe3O4+4H2
Fe3O4+4H2
(2)黑色粉末变为红色(试管右侧靠近出气口处有水珠)
(3)KSCN溶液;酸性KMnO4溶液
(4)①2Fe2++Cl2==2Fe3++2Cl- ;②出现少量晶体或晶膜; Fe3+ +3H2O Fe(OH)3 +3H+
Fe(OH)3 +3H+
(5)2Fe3+ +H2S ==2Fe2+ +S↓+2H+
本题解析:
本题难度:一般
4、实验题 中学实验室用下图装置制取少量溴苯,请填写下列空白。

(1)在烧瓶a中装的试剂是苯、液溴和铁屑,导管b的作用有两个:一是导气,二是兼起________的作用。
(2)反应过程中在导管c的下口附近可以观察到有白雾出现,这是由于反应生成的__________遇水蒸气形成的。
(3)反应完毕后,向锥形瓶d中滴入AgNO3溶液,有________________ 生成。
(4)反应完毕后,将烧瓶a中的液体倒人盛有冷水的烧杯里,可以观察到烧杯底部有_____________色不溶于水的液体,这是溶解了_______________的溴苯的粗产品。
(5)写出烧瓶a中发生反应的化学方程式:________________________________。
(6)提纯粗溴苯的方法是_____________ ,纯净的溴苯是_________色,密度比水_________(填 “小”或“大”)的油状液体。
参考答案:(1)冷凝
(2)HBr
(3)淡黄色沉淀
(4)褐;液溴
(5)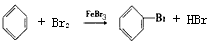
(6)加入NaOH溶液,振荡后分液,下层即为溴苯;无;大
本题解析:
本题难度:一般
5、实验题 已知使用林德拉催化剂(Pd/PbO、CaCO3,其中钯附于碳酸钙及少量氧化铅上)可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化。现有一课外活动兴趣小组利用上述原理设计了一套由如下图所示的仪器组装而成的实验装置(铁架台未画出),由乙炔制得乙烯,并测定在氢化反应中乙炔的转化率。若用含0.020 mol CaC2的电石和含1.30g锌的锌粒(杂质不与酸反应)分别与足量的饱和食盐水和稀硫酸反应,当反应完全后,假定在标准状况下测得G中收集到的水的体积为V mL(忽略乙炔在水中溶解的部分)。试回答下列问题:
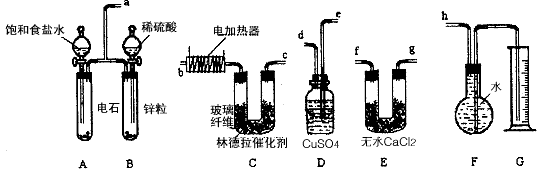
(1)各装置的连接顺序为a→_____ →_____→_____→ _____→_____ → _____→h。
(2)写出C中所发生的两个反应的化学方程式:__________ 。
(3)装置A中产生气体的反应速率往往太快,为了减慢反应速率,操作时还应采取的措施是________。
(4)装置D的作用______________ 。
(5)G所选用的量筒的容积较合理的是_________ (填写选项字母)。
A. 500mL
B. 1000mL
C. 2000mL
(6)若V=672(导管内气体体积忽略不计),则乙炔的转化率为___________。
参考答案:(1)e→d→f→g→b→c或e→d→g→f→b→c
(2)HC≡CH+H2 CH2=CH2
CH2=CH2
(3)通过调节分液漏斗的活塞,缓慢滴入饱和食盐水
(4)除去杂质气体
(5)B
(6)50%
本题解析:
本题难度:一般