微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题
(10分)(1)AgNO3的水溶液呈?(填“酸”、“中”、“碱”)性,常温时的pH ?7(填“>”、“=”、“<”),原因是(用离子方程式表示):?;?实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以?(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈?性,原因是(用离子方程式表示):?________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是??。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的??。
参考答案:(10分)(方程式2分,其余1分)
(1)酸,<,Ag++ H2O 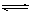 ?AgOH + H+,抑制。
?AgOH + H+,抑制。
(2)酸,Al3++3H2O 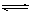 ?Al(OH)3+3H+, Al2O3?;
?Al(OH)3+3H+, Al2O3?;
(3)NaOH
本题解析:(1)AgNO3为强酸弱碱盐,水溶液呈酸性,常温时的pH <7,原因是:Ag++ H2O 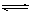 ?AgOH + H+,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。
?AgOH + H+,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。
(2)氯化铝为强酸弱碱盐,水溶液呈酸性,其原因是:Al3++3H2O 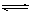 ?Al(OH)3+3H+,当把把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3;
?Al(OH)3+3H+,当把把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3;
(3)硫化钠溶液为强碱弱酸盐,水溶液呈碱性,为了防止发生水解,可以加入少量的NaOH
本题难度:一般
2、填空题 (1)向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为?。
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到白色沉淀转变为红褐色沉淀。简述产生该现象的原因:?。
(3)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字): c(OH-)-c(HA)=??mol/L。
(4)已知25℃时,AgCl的溶解度为1.435×10-4g,则该温度下AgCl的溶度积常数
Ksp= ??mol2/L2。
电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式
| 电离常数(25℃)
|
HCN
| K=4.9×10-10
|
CH3COOH
| K=1.8×10-5
|
H2CO3
| K1=4.3×10-7、K2=5.6×10-11
|
(5)25℃时,有等物质的量浓度的A. Na2CO3溶液、B. NaCN溶液、C.CH3COONa溶液,三溶液的pH由大到小的顺序为?。(用字母表示)
(6)向NaCN溶液中通入少量CO2,所发生反应的化学方程式为?。
参考答案:(每空2分,共 12分)
(1)Fe3+?+ 3HCO3- = Fe(OH)3 ↓ +3CO2 ↑(2分)
(2)Fe(OH)3溶度积(或Ksp或溶解度)比Mg(OH)2更小(2分)
(3)10-8 (2分)?
(4)1.0×10-10 (2分)
(5)A>B>C?(2分)?
(6)NaCN+ H2O+ CO2=HCN+ NaHCO3(2分)
本题解析:(1)Fe3+和HCO3-发生双水解,离子方程式为:Fe3+?+ 3HCO3- = Fe(OH)3 ↓ +3CO2 ↑。
(2)Mg(OH)2沉淀转化为了Fe(OH)3沉淀,说明Fe(OH)3溶度积(或Ksp或溶解度)比Mg(OH)2更小。
(3)由质子守恒定律得:c(OH-)="c(HA)+" c(H+),即c(OH-)-c(HA)= c(H+)=10-8。
(4)溶解度是在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的质量,100g 水即是0.1L,1.435×10-4gAgCl,即10-6mol,故c(Ag+)= c(Cl-)=10-5mol/L,所以Ksp= c(Ag+)* c(Cl-)=1.0×10-10 mol2/L2。
(5)盐类的水解规律是“有弱就水解,越弱越水解,谁强显谁性”,又因电离常数越小,酸性越弱,故PH由大到小的顺序为A>B>C。
(6)根据“强酸制弱酸定律”,方程式为:NaCN+ H2O+CO2=HCN+ NaHCO3。
点评:本题重点考查的盐类的水解和溶解平衡的相关知识,难度大,注意学习教材的知识并多加练习。
本题难度:困难
3、选择题 在0.1 mol·L-1Na2CO3溶液中,各种微粒之间存在下列关系,其中不正确的是(?)
A.c(Na+)+c(H+)=2c( )+c(
)+c( )+c(OH-)
)+c(OH-)
B.c(Na+)=2[c( )+c(
)+c( )+c(H2CO3)]
)+c(H2CO3)]
C.c(OH-)=c(H+)+c( )+2c(H2CO3)
)+2c(H2CO3)
D.c(Na+)=c( )=c(OH-)=c(H+)
)=c(OH-)=c(H+)
参考答案:D
本题解析:Na2CO3溶液发生的变化有:Na2CO3电离:Na2CO3====2Na++
 水解:
水解:
 +H2O
+H2O
 +OH-
+OH-
 +H2O
+H2O H2CO3+OH-
H2CO3+OH-
Na2CO3溶液存在如下微粒:Na+,H+; ,
, ,OH-,H2CO3,H2O。Na2CO3溶液保持电中性,正电荷所带正电荷量等于负电荷所带负电荷量,存在关系:c(Na+)+c(H+)=2c(
,OH-,H2CO3,H2O。Na2CO3溶液保持电中性,正电荷所带正电荷量等于负电荷所带负电荷量,存在关系:c(Na+)+c(H+)=2c( )+c(
)+c( )+c(OH-);Na2CO3溶液中Na+的物质的量为碳原子物质的量的2倍,但碳原子有三种存在形式:
)+c(OH-);Na2CO3溶液中Na+的物质的量为碳原子物质的量的2倍,但碳原子有三种存在形式: ,
, ,H2CO3,故存在关系:c(Na+)=2[c(
,H2CO3,故存在关系:c(Na+)=2[c( )+c(
)+c( )+c(H2CO3)];在Na2CO3溶液中OH-都来自水的电离,水电离出c(H+)=c(OH-),H+在溶液中有三种存在形式:H+、
)+c(H2CO3)];在Na2CO3溶液中OH-都来自水的电离,水电离出c(H+)=c(OH-),H+在溶液中有三种存在形式:H+、 、H2CO3,故存在关系:c(OH-)=c(H+)+c(
、H2CO3,故存在关系:c(OH-)=c(H+)+c( )+2c(H2CO3);可知c(
)+2c(H2CO3);可知c( )<c(OH-),因此D不正确。
)<c(OH-),因此D不正确。
本题难度:简单
4、填空题 在一定条件下Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
A.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
B.升高温度,溶液的PH值减小
C.稀释溶液,溶液中c(H+)和c(OH-)都减少
D.加入NaOH固体,溶液pH减小
参考答案:A
本题解析:略
本题难度:一般
5、选择题 在醋酸与氢氧化钠溶液的反应过程中,溶液中的相关离子浓度呈现出下列排列顺序: c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。满足该条件的反应是
A.0.01mol·L-1的CH3COOH与pH=12的NaOH溶液等体积混合
B.0.2 mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合
C.CH3COOH溶液与NaOH溶液混合后所得溶液的pH=7
D.0.1 mol·L-1的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合
参考答案:B
本题解析:A错,0.01mol·L-1的CH3COOH与pH=12的NaOH溶液等体积混合,混合后溶液中溶质为醋酸钠,溶液中离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);B正确;C错,CH3COOH溶液与NaOH溶液混合后所得溶液的pH=7即得c(CH3COO-)=c(Na+)>c(H+)=c(OH-);D错,.0.1 mol·L-1的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合,其溶液中离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
本题难度:一般