微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如下图。
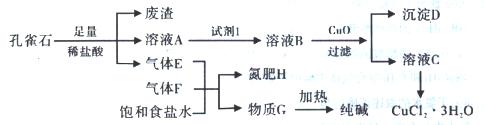
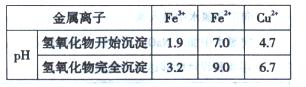
且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如表所示。回答下列问题:
(1)图中“试剂1”为? ?。
?。
(2)加入CuO作用是调节溶液pH,则pH的范围为?。
(3)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通人饱和食盐水中。其中,应先通入气体是?(填代号及对应物质的化学式)
(4)由溶液C获得CuCl2·3H2O,需要经过?、?、过滤等操作。
(5)已知:常温下Cu(OH)2的Ksp=2×10-20。计算Cu2++2H2O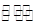 Cu(OH)2+2H+反应平衡常数?。
Cu(OH)2+2H+反应平衡常数?。
参考答案:

本题解析:略
本题难度:一般
2、选择题 某二元酸(简写为H2A)溶液,按下式电离: H2A=H++HA- HA-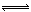 H++A2-,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:(?)
H++A2-,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:(?)
A.溶液肯定不显中性,但显酸性还是碱性无法确定
B.常温下0.1mol/L的NaHA溶液的PH=2
C.溶液中c(Na+)=c(HA-)+ c(A2-)
D.溶液中c(Na+)>c(HA-)>c(A2-)>c(H+)
参考答案:C
本题解析:由电离方程式可以知道H2A的一级电离为强电离,二级电离为弱电离,所以HA-不发生水解,只发生电离,电离显酸性所以NaHA溶液显酸性,A错误;由于HA-的电离是弱电离所以无法计算常温下0.1mol/L的NaHA溶液中的氢离子浓度,无法确定PH的具体值,B错误;根据NaHA溶液中的元素守恒可以知道钠元素与A元素的浓度之比为1:1,所以c(Na+)=c(HA-)+ c(A2-),C正确;NaHA溶液中,HA-电离出的H+和A2-浓度相等,但是考虑水电离出H+所以c(H+)>c(A2-),D错误;答案选C。
本题难度:简单
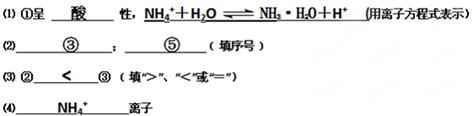
3、填空题 (12分)在常温下,下列五种溶液:①0.1mol/L NH4Cl ?②0.1mol/L CH3COONH4③0.1mol/L NH4HSO4?④0.1mol/L NH3·H2O和 0.1mol/L NH4Cl混合液?⑤0.1mol/L NH3·H2O请根据要求填写下列空白:
?②0.1mol/L CH3COONH4③0.1mol/L NH4HSO4?④0.1mol/L NH3·H2O和 0.1mol/L NH4Cl混合液?⑤0.1mol/L NH3·H2O请根据要求填写下列空白:
(1)溶液①呈??性(填“酸”、“碱”或“中”),其原因是??(用离子方程式表示)
(2)在上述五种溶液中,pH最小的是?;c(NH4+)最小的是??﹝填序号﹞
(3)比较溶液②、③中c(NH4+)的大小关系是②?③﹝填“>”、“<”或“=”)
(4)在溶液④中NH3·H2O和?离子的物质的量浓度之和为0.2 mol/L。
参考答案:
本题解析:略
本题难度:一般
4、选择题 下列有关农业问题,所采取的措施或解释属于正确的是(?)
A.铵态氮肥和草木灰(含K2CO3)能混合施用
B.化肥和农家肥(如绿肥)不可混合施用
C.“盐碱地”中有Na2CO3通过加石膏使之生成碳酸钙,这样根据平衡移动原理,随着c(CO32—)浓度的降低,“盐碱地”的碱性降低
D.复合肥(如磷酸氢二铵)和生石灰能一起施用
参考答案:C
本题解析:铵态氮肥与草木灰混合可双水解,营养流失;化肥和农家肥完全可混合施用;复合肥(如磷酸氢二铵)和生石灰能一起施用,两者将反应生成正盐磷酸钙,不能溶于水,不能被植物吸收。“盐碱地”中Na2CO3水解使土壤成碱性,即:CO32-+H2O HCO3-+OH-,通过加石膏生成沉淀,减少c(CO32—)浓度,平衡左移,土壤碱性减弱。故答案为C
HCO3-+OH-,通过加石膏生成沉淀,减少c(CO32—)浓度,平衡左移,土壤碱性减弱。故答案为C
本题难度:一般
5、选择题 对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A.0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.0.1 mol/L的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中:
c(Na+)+c(H+)=c(A-)+c(Cl-)
D.在25℃100 mL NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
参考答案:D
本题解析: A、0.1 mol/L的(NH4)2SO4溶液中NH4+水解,溶液显酸性,则溶液中离子浓度大小关系是c(NH4+)>c(SO42-)>c(H+)>c(OH-),A不正确;B、0.1 mol/L的NaHCO3溶液中根据物料守恒可知c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),B不正确;C、将0.2 mol/L NaA溶液和0.1 mol/L盐酸等体积混合所得碱性溶液中含有相同浓度的HA和NaA,溶液显碱性,说明A-的水解程度大于HA的电离程度,因此根据电荷守恒可知溶液中离子浓度大小关系是c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-),C不正确;D、在25℃100 mL NH4Cl溶液中根据物料守恒可知c(Cl-)=c(NH4+)+c(NH3·H2O),D正确,答案选D。
本题难度:一般