|
高中化学知识点大全《弱电解质电离平衡》高频考点强化练习(2017年最新版)(四)
2017-07-27 08:09:10
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸 Ka= 1.75×10-5
碳酸 Ka1= 4.30×10-7 Ka2 = 5.61×10-11
亚硫酸 Ka1= 1.54×10-2 Ka2 = 1.02×10-7
(1)写出碳酸的第一步电离平衡常数表达式:Ka1 = ;
碳酸的第一步电离比第二步电离 (填“容易” 或 “困难”)。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱: > >
(3)若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)
A.c(CH3COO-)
B.c(H+)
C.醋酸的电离平衡常数
D.醋酸的电离度
|
参考答案:(1)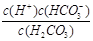 容易 (2)H2CO3 > HSO3- > HCO3- (3) A D 容易 (2)H2CO3 > HSO3- > HCO3- (3) A D
本题解析:(1)碳酸的第一步电离方程式为H2CO3 H++HCO3-,所以电离平衡常数表达式为Ka1 = H++HCO3-,所以电离平衡常数表达式为Ka1 = 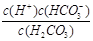 。由于第一步电离出的氢离子会抑制第二步的电离,所以碳酸的第一步电离比第二步电离容易。 。由于第一步电离出的氢离子会抑制第二步的电离,所以碳酸的第一步电离比第二步电离容易。
(2)酸电离平衡常数越大,说明酸越强。所以根据电离平衡常数可知,H2CO3、HCO3-和HSO3-的酸性强弱顺序为H2CO3 > HSO3- > HCO3-。
(3)加入乙酸,增大氢离子浓度,抑制醋酸的电离,所以选项AD减小,B增大,C不变。
本题难度:一般
2、选择题 下列物质中,属于弱电解质的是(?)
A.氨水
B.冰醋酸
C.酒精
D.硫酸钡
参考答案:B
本题解析:电解质是在水溶液中或熔化状态下能够导电的化合物。弱电解质是在水溶液中只有部分电离产生离子的电解质。A.氨水是混合物。错误。B.冰醋酸在水分子的作用下,部分发生电离:CH3COOH CH3COO-+H+。还存在着电解质分子。是弱电解质。正确。C.酒精是非电解质。D.硫酸钡尽管难溶于水,但是溶于水的完全电离,所以是强电解质。错误。 CH3COO-+H+。还存在着电解质分子。是弱电解质。正确。C.酒精是非电解质。D.硫酸钡尽管难溶于水,但是溶于水的完全电离,所以是强电解质。错误。
本题难度:一般
3、填空题 (9分)完成以下小题:
(1)已知NaHSO3溶液显酸性,则溶液中各离子浓度从大到小的顺序是 。
(2)25℃时,向pH=4的NaHSO4溶液中,逐滴加入pH=9的Ba(OH)2溶液至中性,则该过程的离子反应方程式 ;已知25℃时BaSO4的Ksp=1.0×10-10,则以上过程中 沉淀生成(填“有” 或“无”)。
(3)某温度下,0.1 mol·L-1Na2CO3溶液中c(Na+)
参考答案:
本题解析:
本题难度:一般
4、实验题 限使用下列试剂:酚酞溶液、石蕊试液、稀氨水、氯化铵晶体、浓盐酸、熟石灰粉末、醋酸铵晶体和蒸馏水。根据(1)弱碱在水中存在电离平衡;(2)弱碱的阳离子会破坏水的电离平衡。这两种平衡移动均会引起指示剂颜色变化。由此可分别选用上述试剂,设计两个实验证明NH3·H2O是弱碱。请简述实验方法及现象。
(1)应用根据(1)的实验方法及现象?
(2)应用根据(2)的实验方法及现象?
参考答案:(1)取少量稀氨水,滴入酚酞试液,溶液呈红色,加入醋酸铵晶体,溶液的红色变浅。
(2)取少量氯化铵晶体,加蒸馏水溶解,滴入紫色石蕊试液,溶液变红色
本题解析:考查弱电解质的判定
(1)依据电离平衡NH3·H2O NH4++OH-可知,在稀氨水中,加入铵盐氯化铵晶体,由于NH4+浓度增大,平衡左移,OH-的浓度减小,红色变浅 NH4++OH-可知,在稀氨水中,加入铵盐氯化铵晶体,由于NH4+浓度增大,平衡左移,OH-的浓度减小,红色变浅
(2)弱离子可水解:NH4++H2O NH3·H2O+H+使溶液呈酸性,故可取氯化铵晶体配成溶液,滴入紫色石蕊试液,溶液呈红色 NH3·H2O+H+使溶液呈酸性,故可取氯化铵晶体配成溶液,滴入紫色石蕊试液,溶液呈红色
本题难度:简单
5、选择题 将C(H+)=1×10-2mol·L-1的CH3COOH和HNO3溶液分别稀释100倍,稀释后两溶液的H+的物质的量浓度分别为a和b,则a和b的关系为
[? ]
A.a>b
B.a<b
C.a=b
D.不能确定
参考答案:A
本题解析:
本题难度:一般
|