微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中,能证明某物质是弱电解质的是
A.熔化时不导电
B.不是离子化合物,而是极性共价化合物
C.溶液中已电离的离子和未电离的分子共存
D.水溶液的导电能力很差
参考答案:C
本题解析:A、熔化时不导电,说明没有自由移动的离子,但不是弱电解质的特征,如蔗糖是非电解质,HCl为强电解质,熔化时不导电,故A错误。B、电解质的强弱是根据其电离程度划分的,与是离子化合物还是共价化合物无关,故B错误;C、弱电解质是指:在水溶液里部分电离的电解质.既有电解质的分子又有弱电解质电离出的离子,如水就是,水是弱电解质,既有水分子,又有水电离出的氢离子和氢氧根离子,所以稀溶液中已电离的离子和未电离的分子共存是弱电解质,故C正确;D、水溶液的导电能力与溶液中的离子浓度有关,离子浓度大,导电能力强,如硫酸钡是强电解质,在水中难溶,水中离子浓度小,导电能力弱,所以水溶液的导电能力的不一定是弱电解质,故D错误。
本题难度:一般
2、选择题 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是
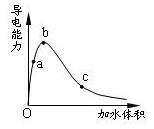
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
C.a、b、c三点中b点n(H+)最大
D.a、b、c三点醋酸的电离程度:a<b<c
参考答案:D
本题解析:酸电离平衡为:CH3COOH CH3COO—+H+
CH3COO—+H+
冰醋酸加水稀释过程中,电离度一直在增大,但醋酸浓度一直在减小,而c(H+)=cα;从图中可看出c(H+)是先增大后减小。而c(H+)决定了溶液的酸碱性及导电能力。但在稀释过程中,CH3COOH的量不会改变,故中和时所耗氢氧化钠的量是不会改变的。
本题难度:一般
3、填空题 某二元弱酸溶液按下式发生一级和二级电离:
H2A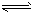 H++HA-
H++HA-
HA- H++A2-。
H++A2-。
已知相同浓度时的电离度,a(H2 A)>a(HA-),设有下列四种溶液:
A.0. 01mol/L的H2A溶液
B.0. 01mol/L的NaHA溶液
C.0. 02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液
D.0. 02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合液
据此填写下列空白(填代号):
(1)c(H+)最大的是____,最小的是____。
(2)c(H2A)最大的是____,最小的是____。
(3)c(A2-)最大的是____,最小的是____。
参考答案:(1)A ;D
(2)C ;D
(3)D ;A
本题解析:
本题难度:一般
4、选择题 将pH=11 NaOH溶液和pH=3的甲酸溶液以等体积混合后,对所得溶液,下列判断一定正确的是( )
A.c(HCOO-)< c(Na+)
B.c(HCOO-)> c(Na+)
C.c(OH-)< c(HCOO-)
D.c(OH-)> c(HCOO-)