| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《化学平衡》试题巩固(2017年最新版)(三)
F.平衡后升高温度,平衡常数K增大 2、选择题 下列有关叙述正确的是( ) |
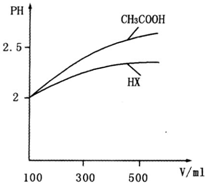
3、简答题 已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO 平衡常数 Ka=1.8×10-5 Ka1=4.3×10-7 Ka2=5.6×10-11 Ka=3.0×10-8 | |
4、选择题 A、B两相同容器内均进行如下反应CO(g)+H2(g) CO2(g)+H2(g) △H=-43 kJ/mol下列有关说法正确的是
CO2(g)+H2(g) △H=-43 kJ/mol下列有关说法正确的是
[? ]
A.由图象可知,B容器内反应速率较快
B.前2 min内,A容器中v(CO)=1.5 mol·L-1·min-1
C.若容器体积为10L,则3min内,B容器中反应放出热量43 kJ
D.将A、B容器体积均压缩至原来的一半,则两容器内平衡均向右移动
5、选择题 一定条件下,在体积为10L的密闭容器中,1 molX和1 molY发生反应:2x(g)+Y(g) Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
A.反应进行30 s时,正反应速率等于逆反应速率
B.反应进行80 s时,逆反应速率大于正反应速率
C.反应进行60 s时,X的物质的量浓度为0.04 mol/L
D.反应进行60 s时,Y的转化率为70%
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《物质结构与.. | |