| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《化学平衡》试题巩固(2017年最新版)(四)
F.平衡后升高温度,平衡常数K增大 参考答案:(1)BD (2)CH4(g)+N2O4(g) 本题解析:(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。则A、根据图像可知t1时正反应速率仍然在变化,说明没有达到平衡状态,A错误;B、根据图像可知t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,B正确;C、根据图像可知t1时二氧化碳和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,C错误;D、根据图像可知t1时一氧化氮的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,D正确,答案选BD; 本题难度:困难 2、选择题 下列有关叙述正确的是( ) |
参考答案:A
本题解析:A、充入氢气,增大容器的体积,则CO和甲醇的浓度同等倍数的减少,则此时的浓度商与平衡常数相等,所以平衡不移动,CO的转化率不变,正确;B、醋酸是弱酸,当醋酸与氢氧化钠恰好完全反应时生成醋酸钠,而醋酸的物质的量未知,所以c(CH3COO-)+ c(CH3COOH)未知,错误;C、根据盐水解的规律:越弱越水解,三种盐浓度相对时的水解程度的大小顺序是③>②>①,溶液的碱性的顺序也是③>②>①,现在三种溶液的pH相同,所以溶液的浓度的大小关系是③<②<①,则c(Na+)的大小顺序是③<②<①,错误;D、当Cl-与CrO42-的浓度相同时,生成AgCl沉淀时所需Ag+的浓度是Ksp(AgCl)/0.001=1.56×10-7mol/L,生成Ag2CrO4沉淀时所需Ag+的浓度是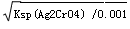 =1×10-4.5mol/L>1.56×10-7mol/L,所以AgCl先沉淀,错误,答案选A。
=1×10-4.5mol/L>1.56×10-7mol/L,所以AgCl先沉淀,错误,答案选A。
考点:考查化学平衡的判断,盐的水解规律的应用,溶液浓度的比较,溶度积的应用
本题难度:困难
3、简答题 已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO 平衡常数 Ka=1.8×10-5 Ka1=4.3×10-7 Ka2=5.6×10-11 Ka=3.0×10-8 | |
参考答案:(1)由电离平衡常数判断酸性的强弱,酸性越强,其对应盐的水解程度越大,溶液的pH就越大,
由表格中的数据可知,酸性CH3COOH>H2CO3>HClO>HCO3-,则水解程度大小顺序为adcb,所以pH由大到小的顺序是a?d?c?b,故答案为:a?d?c?b;
(2)A.CH3COOH溶液加水稀释过程,促进电离,c(H+)减小,故A不选;
B.c(H+)/c(CH3COOH)=n(H+)/n(CH3COOH),则稀释过程中比值变大,故B选;
C.稀释过程,促进电离,c(H+)减小,c(OH-)增大,c(H+)?c(OH-)=Kw,Kw不变,故C不选;
D.稀释过程,促进电离,c(H+)减小,c(OH-)增大,则c(OH-)/c(H+)变大,故D选;
故答案为:BD;
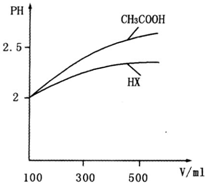
(3)稀释相同的倍数,pH变化大的酸酸性强,由图可知,HX的pH变化程度小,则酸性醋酸强,电离平衡常数小,故答案为:小于,稀释相同倍数,一元酸HX的pH变化比CH3COOH小,故酸性弱,电离平衡常数小;
(4)25℃时,混合液pH=6,c(H+)=1.0×10-6mol/L,则由Kw可知,c(OH-)=1.0×10-8mol/L,由电荷守恒可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=9.9×10-7mol/L,
根据缓冲公式pH=pKa-lg([HAc]/[Ac-]),查数据知道pKa(CH3COOH)=4.76,所以lg([HAc]/[Ac-])=-1.24,即[Ac-]/[HAc]=18,故答案为:9.9×10-7;18.
本题解析:
本题难度:一般
4、选择题 A、B两相同容器内均进行如下反应CO(g)+H2(g)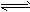 CO2(g)+H2(g) △H=-43 kJ/mol下列有关说法正确的是
CO2(g)+H2(g) △H=-43 kJ/mol下列有关说法正确的是
[? ]
A.由图象可知,B容器内反应速率较快
B.前2 min内,A容器中v(CO)=1.5 mol·L-1·min-1
C.若容器体积为10L,则3min内,B容器中反应放出热量43 kJ
D.将A、B容器体积均压缩至原来的一半,则两容器内平衡均向右移动
参考答案:C
本题解析:
本题难度:一般
5、选择题 一定条件下,在体积为10L的密闭容器中,1 molX和1 molY发生反应:2x(g)+Y(g) Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
A.反应进行30 s时,正反应速率等于逆反应速率
B.反应进行80 s时,逆反应速率大于正反应速率
C.反应进行60 s时,X的物质的量浓度为0.04 mol/L
D.反应进行60 s时,Y的转化率为70%
参考答案:C
本题解析:A.由于反应经60s达到平衡,所以在反应进行30 s时,正反应速率大于逆反应速率,错误;B.由于反应经60s达到平衡,反应进行80 s时,如果外界条件比变化,则平衡保持,逆反应速率等于正反应速率,错误;C.反应进行60 s时,生成0.3mol Z ,根据反应方程式中各种物质之间的关系,可知:X消耗0.6mol,则还有0.4mol的X,故X的物质的量浓度为0.4mol ÷10L=0.04 mol/L,正确;D.反应进行60 s时,达到平衡,根据方程式在Y、Z的关系可知反应消耗Z的物质的量是0.3mol,则Y的转化率为(0.3mol ÷1mol)×100%=30%.
考点:考查可逆反应中的化学反应速率和化学平衡、物质的转化率的知识。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《物质结构与.. | |