微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在6份0.01mol/L氨水中分别加入下列各物质:
A.浓氨水?B.纯水?C.少量浓H2SO4D.少量NaOH固体?E.少量Al2(SO4)3固体
(1)能使[OH-]减小、[NH4+]增大的是______
(2)能使[OH-]增大、[NH4+]减小的是______
(3)能使[OH-]和[NH4+]都增大的是______
(4)能使[OH-]和[NH4+]都减小的是______.
2、选择题 用食用白醋(醋酸浓度约1 mol/L)进行下列实验,能证明醋酸为弱电解质的是
[? ]
A.白醋中滴入石蕊试液呈红色
B.白醋加入豆浆中有沉淀产生
C.蛋壳浸泡在白醋中有气体放出
D.pH试纸显示白醋的pH为2~3
3、简答题 25℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO
电离平衡常数
1.8×10-5
K1=4.3×10-7
K2=5.6×10-11
3.0×10-8
|
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa? d.NaHCO3;pH由大到小的顺序是:______;(填编号)
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是:______;
A.c(H+)?B.c(H+)/c(CH3COOH)?C.c(H+)?c(OH-)?D.c(OH-)/c(H+)
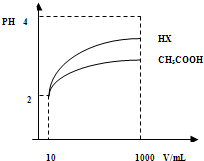
(3)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.则HX的电离平衡常数______(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是______,稀释后,HX溶液中水电离出来的c(H+)______醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:______;
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO-)-c(Na+)=______.(填准确数值).
4、选择题 下列叙述正确的是
A.根据Ksp(PbI2)>Ksp(AgCl)可以得出PbI2在水中的溶解能力比AgCl大
B.常温下,同浓度的Na2CO3与NaHCO3溶液相比,NaHCO3溶液的pH大
C.等物质的量浓度的NH4Cl溶液和NH4HSO4溶液,后者的c(NH4+)大
D.常温下pH=7的氨水与硫酸铵的混合液中c(NH4+)与c(SO42-)之比小于2
5、选择题 在0.1mol·L一CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO一+H+,对于该平衡,下列叙述不正确的是? (? )
CH3COO一+H+,对于该平衡,下列叙述不正确的是? (? )
A.加入水时,平衡向正反应方向移动,溶液中n(H+)增大
B.加入少量冰醋酸,平衡向正反应方向移动,溶液中c(H+)增大
C.加入少量0.1 mol·L-HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向逆反应方向移动,溶液中c(H+)减小