| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《难溶电解质的溶解平衡》高频试题特训(2017年最新版)(二)
参考答案:B 本题解析: 本题难度:一般 2、选择题 化学知识与日常生活密切相关。下列说法不正确的是 |
参考答案:A
本题解析:A.金属活动性Zn>Fe>Sn,所以镀锡铁板不如镀锌铁板更耐腐蚀,错误;B.水常温下呈液态是由于分子之间存在氢键,增加了分子之间的吸引力,冰浮在水面上,由于分子之间存在氢键,由于氢键的存在,增加了分子之间的距离,使其密度比水小,故均与氢键有关,正确;C.纯碱是盐,水解是溶液显碱性,因此可以洗涤油污。由于加热可以促进盐的水解平衡正向移动,使溶液的碱性增强,故用纯碱溶液清洗油污时,加热可增强其去污能力,正确;D.锅炉水垢中含有的CaSO4,CaSO4在溶液中存在沉淀溶解平衡,当向其中加入Na2CO3溶液时,会形成溶解度更小的CaCO3,发生沉淀的转化,然后再加入盐酸,CaCO3与盐酸发生复分解反应,产生可溶性的钙盐,而达到除去杂质的目的,正确。
考点:考查化学知识在日常生活中的应用的知识。
本题难度:一般
3、填空题 我省许多地方都有石灰石矿,有很多用石灰岩制石灰的企业。烧制石灰时,在800℃高温下密闭的石灰窑内存在下列平衡:CaCO3(s) CaO(s)+CO2(g);平衡常数K=c(CO2)=0.003
CaO(s)+CO2(g);平衡常数K=c(CO2)=0.003
(1)将CO2(g)、CaCO3(s)和CaO(s)按下列A、B两种不同的投料方式,放入一个10 L密闭容器中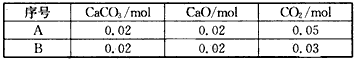
经过足够长时间且维持温度不变,按A种投料方式,容器中CaCO3(s)的物质的量为____mol;按B种投料方式,容器中CaCO3(s)的物质的量为____mol。
(2)美丽的珊瑚和珍珠的主要成分都是碳酸钙,有人用石膏(CaSO4·2H2O)作原料制成了一种红色的“珊瑚礁”,假冒珊瑚出售。请设计一个简单的实验方案区分真假珊瑚礁____。
(3)锅炉水垢中含有较难溶于水又较难溶于酸的CaSO4,可先用碳酸钠溶液处理,使之转化为疏松、易溶于酸的物质,该转化的化学反应方程式是____________________。
参考答案:(1)0. 04;0.02
(2)取少量待检珊瑚礁,滴一滴稀盐酸,若有气泡产生珊瑚礁为真,否则为假
(3)CaSO4(s)+Na2CO3(aq)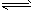 CaCO3(s)+Na2SO4 (aq) (或CaSO4+Na2CO3=CaCO3+Na2SO4)
CaCO3(s)+Na2SO4 (aq) (或CaSO4+Na2CO3=CaCO3+Na2SO4)
本题解析:
本题难度:一般
4、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是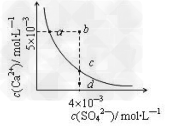
[? ? ]
A.CaSO4在稀硫酸中的溶解性比在纯水中的溶解性大
B.a点对应的Ksp等于c点对应的Ksp
C.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
D.d点溶液通过蒸发可以变到c点
参考答案:B
本题解析:
本题难度:简单
5、选择题 下列有关说法正确的是
A.25℃时,pH=5盐酸和pH=9的氨水,两溶液中水的电离程度不同
B.25℃时,Ksp(A)> Ksp(B),说明化合物A的溶解度比化合物B的大
C.常温下pH=4的盐酸中:c(H+)=c(OH-)+c(Cl-)
D.在NH4Cl溶液中加入适量硫酸,可使c(NH4+):c(Cl-)接近1:1
参考答案:CD
本题解析:由于盐酸是酸,而氨水是碱,故两者都是抑制水的电离,所以25℃时,pH=5盐酸和pH=9的氨水,两溶液中水的电离程度是相同的,故A错误;溶解度的大小与溶度积没有必然的联系,故.25℃时,Ksp(A)> Ksp(B),不能确定化合物A的溶解度比化合物B的大,故B错误;常温下pH=4的盐酸中,根据电荷守恒可以得到,c(H+)=c(OH-)+c(Cl-),故C正确;NH4Cl为强酸弱碱盐,其水溶液中由于铵根离子的水解而呈酸性,加入硫酸可以抑制其铵根离子的水解,所以加入适量硫酸,可使c(NH4+):c(Cl-)接近1:1,故D正确,所以本题的正确答案为CD。
点评:本题考查了强弱电解质、电荷守恒、盐类水解,这些考点均是高考考查的重点和难点,本题要理解的是酸和碱都能够抑制水的电离,无论是强酸还是弱酸,该题难度中等。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《无机非金属.. | |