微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组性质比较中,正确的是
①酸性:HClO4>HBrO4>HIO4?②碱性:Ca(OH)2>Mg(OH)2>Be(OH)2
③原子半径:Cl<S<P?④稳定性:HF > NH3 > H2O
A.①②③
B.②③④
C.①②④
D.①③④
参考答案:A
本题解析:非金属性越强,氢化物的稳定性越强,最高价氧化物的水化物的酸性越强,则①正确,④不正确;金属性越强,最高价氧化物的水化物的碱性越强,则选项②正确;同周期自左向右原子半径逐渐减小,③正确,答案选A。
点评:该题主要是考查学生对元素周期律的熟悉了解程度,以及灵活运用元素周期律解决实际问题的能力,难度不大。该题的关键是熟练记住元素周期律的具体内容,然后结合题意灵活运用即可,有利于培养学生的逻辑思维能力。
本题难度:一般
2、填空题 (1)写出表示含有8个质子,10个中子的原子的化学符号________;
(2)已知阴离子aX2-和阳离子bYn+具有相同的核外电子排布,则a、b、n之间的关系为a=________;
(3)比较下列大小(填“>”或“<”)
A.原子半径:Cl______Na
B.酸性:H2CO3______H2SiO3
(4)某元素R气态氢化物的化学式为RH3,其最高价氧化物中含氧量为 ,已知该元素的原子核中中子数和质子数相等,则该元素的名称是________。
,已知该元素的原子核中中子数和质子数相等,则该元素的名称是________。
参考答案:(1)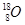 (2)b-n-2 (3)A.< B.> (4)氮
(2)b-n-2 (3)A.< B.> (4)氮
本题解析:(2)中,两种离子aX2-和bYn+具有相同的核外电子排布,说明有下式成立:a+2=b-n,a=b-n-2。
(4)中,由气态氢化物的化学式RH3,可知其最高价氧化物化学式为R2O5。在氧化物中含氧量为 ,可求出元素R的相对原子质量为14,进而确定该元素为氮。
,可求出元素R的相对原子质量为14,进而确定该元素为氮。
本题难度:简单
3、选择题 将饱和氯化铁溶液分别加入到下列液体中,能形成胶体的是
A.冷水
B.沸水
C.氢氧化钠溶液
D.饱和食盐水
参考答案:B
本题解析:分析:根据氢氧化铁胶体的制备方法:将饱和氯化铁溶液加入沸水中.
解答:A、因FeCl3溶液在冷水中水解程度较小,不能形成胶体,故A错误,
B、因FeCl3溶液与沸水发生水解反应,水电离出来的极少量OH-离子与Fe3+结合形成氢氧化铁胶体,故B正确;
C、因FeCl3溶液与NaOH溶液生成红褐色的Fe(OH)3沉淀,故C错误;?
D、因FeCl3溶液与NaCl溶液不反应,不能形成胶体,故D错误;?
故选:B.
点评:本题主要考查了氢氧化铁胶体的制备方法,比较简单.
本题难度:困难
4、选择题 下列叙述中正确的是
A.除零族元素外,所有短周期元素的最高化合价在数值上都等 于该元素所属的族序数
于该元素所属的族序数
B.除短周期外,其他周期均有18种元素
C.副族元素中没有非金属元素
D.碱金属元素是指ⅠA族的所有元素
参考答案:C
本题解析:略
本题难度:一般
5、选择题 右图为元素周期表截取的短周期的一部分,即 。?四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是(? )
。?四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是(? )
A.原子半径:W>Z>Y>X
B.气态氢化物的稳定性:Z>W>X>Y
C.W的最高正化合价与负化合价的绝对值可能相等
D.Z的最高价氧化物的水化物可能为强碱
参考答案:C
本题解析:同周期自左向右原子半径逐渐减小,同主族自上而下,原子半径逐渐增大,所以原子半径应该是Z>W>X>Y,A不正确;非金属性越强,氢化物的稳定性越强。非金属性是:Y>X >W >Z,则选项B不正确;W可能是第ⅣA元素,则W的最高正化合价与负化合价的绝对值可能相等,C正确;根据元素在周期表中的位置可判断,它们均位于第ⅡB族的右侧,所以Z的最高价氧化物的水化物不可能为强碱,D不正确,答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般