微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是( )?
A共价键只存在于共价化合物分子中
B离子键只存在于离子化合物中?
C含有极性键的分子一定是极性分子
D极性分子中一定含有极性键?
参考答案:BD
本题解析:本题主要考查对化合物类型化学键的关系。共价键除了存在于共价化合物中外,还可以存在于某些单质(如Cl2、O2等多原子分子,金刚石、石墨等单质晶体)及含有原子团的离子化合物中(如NH4Cl、Na2SO4);而化合物只要含有离子键,就一定属于离子化合物;含有极性键的分子,如果其分子结构是对称的,分子内电荷的分布是均匀的,正负电荷重心重合,则整个分子就没有极性,这样的分子有很多,如直线型的CO2,平面三角形的BF3、SO3,正四面体的CH4、CCl4等;而极性分子中,正负电荷的重心一定是不重合的,说明其中一定含有极性的共价键。?
本题难度:简单
2、填空题 下表是元素周期表的一部分。
周期?族
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
一
| A
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
二
| ?
| ?
| ?
| ?
| D
| ?
| F
| H
|
三
| B
| ?
| C
| ?
| E
| ?
| G
| ?
|
根据A—H元素在周期表中的位置,用化学式填写下列空白。
(1)单质中氧化性最强的是________________,还原性最强的是________________,化学性质最不活泼的是________________。
(2)最高价氧化物对应水化物的酸性最强的酸是________________________,最稳定的氢化物是________________。
(3)按碱性逐渐减弱、酸性逐渐增强的顺序,将B、C、E、G四种元素的最高价氧化物对应水化物的化学式排列为________________。
(4)D、E、F三种元素按原子半径由大到小的顺序排列为________________。
(5)A的氧化物常温下呈____________态,它和B的单质反应后所得溶液的pH_______7。
参考答案:(1)F2? Na? Ne
(2)HClO4? HF
(3)NaOH、Al(OH)3、H3PO4、HClO4
(4)P>N>F
(5)液?>
本题解析:由表知:A为H,B为Na,C为Al,D为N,E为P,F为F,G为Cl,H为Ne,依据元素周期律可得出答案。
本题难度:一般
3、选择题 下列有关物质结构和性质的说法中,正确的是(?)
A.因为水溶液的酸性:HCl>H2S,所以非金属性:Cl>S
B.同周期第ⅡA族与第IIIA族的元素原子序数之差不一定为1
C.元素原子的最外层电子数越多,越容易得电子,非金属性越强
D.同周期主族元素的原子形成的简单离子电子层结构相同
参考答案:B
本题解析:A、根据最高价氧化物水合物的酸性强弱比较非金属性,错误;B、第4、5、6、7周期同周期第ⅡA族与第IIIA族之间出现了过渡元素,正确;C、非金属性强弱与元素原子的最外层电子数的多少无关,错误;D、同周期主族元素金属与非金属原子形成的简单电子层结构不同,错误。
本题难度:一般
4、选择题 在一定条件下,RO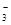 与R-可发生反应:RO
与R-可发生反应:RO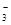 +5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
A.元素R位于周期表中第ⅤA族
B.RO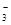 中的R只能被还原
中的R只能被还原
C.CaR2是离子化合物,阴阳离子电子层结构相同,且既含有离子键,又含有共价键
D.3 mol R2中,氧化产物与还原产物的质量比为5︰1
参考答案:D
本题解析:A.由于元素R形成的简单离子是R-。说明R一种的最外层有7个电子,因此位于周期表中第ⅦA族.错误。B.在RO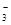 中的R的化合价为+5价,处于该元素的中间价态,所以既能被氧化,也能被还原。错误。C.R是第ⅦA族元素,CaR2是离子化合物,若R是Cl,则阴阳离子电子层结构相同,若R是Br, 则阴阳离子电子层结构不相同。在化合物中只含有离子键,不含有共价键。错误。D.在上述反应方程式中,根据电子守恒可知:每产生3 mol R2,氧化产物与还原产物的质量比为5︰1。正确。
中的R的化合价为+5价,处于该元素的中间价态,所以既能被氧化,也能被还原。错误。C.R是第ⅦA族元素,CaR2是离子化合物,若R是Cl,则阴阳离子电子层结构相同,若R是Br, 则阴阳离子电子层结构不相同。在化合物中只含有离子键,不含有共价键。错误。D.在上述反应方程式中,根据电子守恒可知:每产生3 mol R2,氧化产物与还原产物的质量比为5︰1。正确。
本题难度:一般
5、选择题 下列各组物质间的无色溶液,不用其它试剂即可鉴别的是
A.NaOH、AlCl3
B.H2SO4、BaCl2
C.Na2CO3、HCl
D.AgNO3、KCl
参考答案:AC
本题解析:不用其他试剂就可以鉴别的,一般采用互滴的方法,且两者现象不一样。A、将NaOH加到AlCl3中,先产生沉淀,后溶解;将将AlCl3加到NaOH中,先无沉淀产生,后产生沉淀;C、将HCl滴加到Na2CO3中,先无气体,后产生气体;而反滴开始就有气体
本题难度:困难