| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《弱电解质电离平衡》答题技巧(2017年最新版)(四)
参考答案:C 本题解析:一定温度下,液氨中c(NH4+)与c(NH2-)的乘积就是该平衡的平衡常数,A正确;c(NH4+)和c(NH2-)按1 本题难度:一般 3、选择题 某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是 参考答案:A 本题解析:A.由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成的溶液,电离的CH3COOH与NaOH反应,仍可以继续电离使溶液呈酸性,且溶液中只有Na+、CH3COO-、H+、OH-四种离子;B.由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成,CH3COOH与NaOH恰好反应生成CH3COONa,溶液水解呈碱性;C.溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)不满足电荷守恒;D.加入大量的氨水,c(NH 本题难度:一般 4、选择题 下表是不同pH环境时某浓度铬酸(H2CrO4)溶液中,离子浓度(mol/L)与pH的关系,下列说法错误的是
A.铬酸第一级电离方程式为H2CrO4 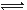 H++HCrO4— H++HCrO4—B.要得到CrO42—应控制溶液的pH>9? C.当电离达到平衡时,2v(正)(HCrO4—)= v(逆)(Cr2O72—) D.该铬酸溶液的物质的量浓度约为1.00mol/L? 参考答案:AC 本题解析:A由表中的数据在PH=4时,c(HCrO4—)= 0.1040可知:铬酸第一级电离方程式为H2CrO4 =H++HCrO4—。错误。B.由表中的数据可知:当PH=9时c(CrO42—)= 0.9960mol/L而c(HCrO4—)、c(Cr2O72—)很小很小。可?见要得到CrO42—应控制溶液的pH>9。正确。C.当电离达到平衡时, v(正)(HCrO4—)= 2v(逆)(Cr2O72—)。错误。D根据Cr守恒可确定c(H2CrO4)= c(CrO42—)+ c(HCrO4—)+2 c(Cr2O72—)= 0.9960+0.0031+0.0004×2=0.9999mol/L.因此该铬酸溶液的物质的量浓度约为1.00mol/L?。正确。2CrO4)溶液中,离子浓度与pH的关系的知识。 本题难度:一般 5、选择题 有4种混合溶液,分别由等体积0.1 mol·L-1的2种溶液混合而成:①CH3COONa与NaCl;②CH3COONa与NaOH;③CH3COONa与NaHSO4;④CH3COONa与NaHCO3,c(CH3COO-)排序正确的是 |
参考答案:A
本题解析:CH3COO-水解使溶液显碱性,NaCl对CH3COO-的水解没有影响,NaOH抑制CH3COO-的
水解,使CH3COO-的浓度增大,NaHSO4促进CH3COO-的水解,使得CH3COO-的浓度减小,NaHCO3也抑制CH3COO-的水解,但抑制程度没有NaOH强,故选A
考点:盐类水解的影响因素。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《反应速率与.. | |