微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)[选做题]本题包括A、B两小题,分别对应于 “物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.铁是地壳中含量较丰富的元素,仅次于氧、硅、铝元素,其单质及合金是在生产生活中应用广泛的金属材料。化学上常用KSCN溶液等来检验溶液中是否存在Fe3+。
(1)Fe3+离子基态的电子排布式可表示为?。
(2)一种铁晶体的晶胞属于体心立方堆积,则该晶胞中所包括的铁原子的个数是?。
(3)C、N两种元素的简单气态氢化物的热稳定性由强到弱的顺序为?。
(填化学式)
(4)C、N、O三种元素的第一电离能由大到小的顺序为?。(填元素符号)
(5)离子化合物Fe2O3的熔点高于KC1的熔点的原因是?。
(6)据报道:由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如右图所示。晶体中距每个X原子周围距离最近的Q的原子的个数是?。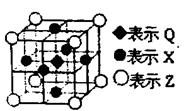
参考答案:A.(1)1s22s22p63s23p63d5(2)2
(3)NH3>CH4(4)N>O>C
(5)Fe2O3的晶格能大于KCl的晶格能(6)2
本题解析:(1)根据构造原理可知,Fe3+离子基态的电子排布式可表示为1s22s22p63s23p63d5。
(2)在体心立方堆积中,含有的铁原子个数是8×1/8+1=2。
(3)非金属性越强,相应氢化物的稳定性越强,N的非金属性强于C的,所以稳定性是NH3>CH4。
(4)非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子处于半充满状态,所以第一电离能大于氧元素的,即N>O>C。
(5)由于Fe2O3的晶格能大于KCl的晶格能,所以离子化合物Fe2O3的熔点高于KC1的熔点。
(6)Q位于体心处,X位于面心处,所以晶体中距每个X原子周围距离最近的Q的原子的个数是2个。
本题难度:一般
2、填空题 (16分) A、B、C、D、E、F属于短周期主族元素。A的原子半径在短周期中最大,B的一种原子中,质量数与质子数之差为零, C与D、E与F均同主族,C元素的原子L层电子数是K层的2倍,E原子的核外电子总数等于C、D原子核外电子总数的差。?
(1)离子B-的结构示意图为?;化合物CE2的分子属于?分子(填“极性”或“非极性”);用电子式表示化合物A2F的形成过程?。
(2)A、E、F形成的简单离子的半径由大到小的顺序为?(用离子符号表示);元素C、D、E形成的常见单质中,熔沸点由高到低的顺序是(用名称表示)
?
(3)由B、C可以构成的最简单的化合物W,取16.0g分子式为W·8H2O的化合物,将其释放的W完全燃烧生成液态水,可放出89.03kJ的热量,则W燃烧的热化学方程式为?
(4)使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一。有人设计制造了一种燃料电池,一个电极通入富含E单质的气体和少量CE2,另一电极通入液化石油气(以C4H10表示),电池的电解质是熔融的K2CO3。该电池的负极反应式为?,电池工作时,电解质里的CO32-向?极移动。
参考答案:
(1) (2分);非极性(1分);
(2分);非极性(1分); (2分)
(2分)
(2)S2->O2->Na+(2分);金刚石(或石墨)>晶体硅>硫(2分)
(3)CH4(g) + 2O2(g) = CO2(g) + 2H2O(l); kJ/mol(3分)
kJ/mol(3分)
(4)C4H10 – 26e-+ 13CO32-= 17CO2 + 5H2O(3分);负(1分)
本题解析:略
本题难度:一般
3、选择题 镭是元素周期表中第7周期第ⅡA族元素,关于其叙述不正确的是( )。
A.镭的金属性比钙弱
B.单质能与水反应生成H2
C.镭在化合物中呈+2价
D.碳酸镭难溶于水
参考答案:A
本题解析:镭是第ⅡA族元素,自上至下,元素的金属性增强,故比钙还活泼,与水反应生成氢气,A错误,B正确;最外层有2个电子,在化合物中呈+2价,类比碳酸钙难溶于水,碳酸镭也难溶于水,C、D正确。
本题难度:一般
4、选择题 按电子排布,可把周期表里的元素划分成5个区,以下元素属于p区的是
A.Fe
B.Mg
C.P
D.La
参考答案:C
本题解析:区的名称来自于按照构造原理最后填入电子的轨道名称,所以根据构造原理可知,镁属于P区,铁是d区,P是p区,La是d区,答案选C。
本题难度:简单
5、填空题 (8分)有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间。
(1)元素②在周期表中的位置为?周期?族;②、⑦、⑧三种元素的原子半径由小到大的顺序是?(用元素符号表示)。②、⑦、⑧三种元素最高价氧化物对应水化物的酸性由强到弱的顺序是?(用化学式表示)。
(2)如图所示,甲、乙、丙、丁均为①~⑧中某些元素形成的单质或化合物,反应a为置换反应,反应b为化合反应(反应条件已略去),单质乙与单质丙所含元素位于同一主族,任写一个符合条件的反应a的化学方程式:?。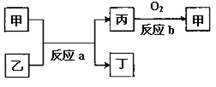
参考答案:
(1)二、ⅣA(2分);C Cl S (2分);? HClO4?H2SO4?H2CO3(2分)
(2)2Na+2H2O=2NaOH+H2↑ 或 (2分)
(2分)
本题解析:略
本题难度:一般