微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 英国化学家戴维(Davy)用电解法成功地制出了金属钾和钠。他临终前在医院养病期间,一位朋友去看他,问他一生中最伟大的发现是什么,他绝口未提自己发现的众多化学元素中的任何一个,却说:“我最大的发现是一个人——法拉第!”钠(Na)在周期表中的位置是
A.第二周期第IA族
B.第二周期第IIA族
C.第三周期第IA族
D.第三周期第IIA族
参考答案:C
本题解析:钠是11号元素,其原子结构示意图是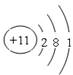 。由于主族序数=最外层电子数,周期数=电子层数,所以钠元素位于第三周期第IA族,答案选C。
。由于主族序数=最外层电子数,周期数=电子层数,所以钠元素位于第三周期第IA族,答案选C。
点评:该题是基础性试题的考查,也是高考中的常见考点和题型。该题的关键是明确钠元素的核外电子排布以及主族序数、周期数的计算判断依据,然后结合题意灵活运用即可,难度不大。
本题难度:简单
2、选择题 用20.0mL,0.100mol/L的含氧酸HnRO4溶液与15.0mL,0.200mol/L的某M(OH)m溶液恰好完全反应全部生成正盐,则用m来表示的R的化合价是(? )
A.+(8-2m/3)
B.+(8-2m)
C.+(8-3m/2)
D.+(8-3m)
参考答案:C
本题解析:恰好生成正盐,说明氢离子的物质的量和OH-的物质的量相等。即0.02L×0.100mol/L×n=0.015L×0.200mol/L×m,解得n=3m/2。所以R的化合价是+(8-3m/2)。答案是C。
本题难度:一般
3、选择题 科学家对原子结构的认识顺序正确的是
①道尔顿原子模型;②汤姆生原子模型;③卢瑟福原子模型;④电子云模型
A.①③②④
B.④①②③
C.①②③④
D.④②③①
参考答案:C
本题解析:①1803年道尔顿原子模型;②1904年汤姆生原子模型;③1911年卢瑟福原子模型;④1927年德国物理学家海森堡提出了现代电子云模型。
本题难度:一般
4、选择题 下列各组粒子不能互称为等电子体的是(?)
A.CO和N2
B.N2H4和 C2H4
C.CO2和N2O
D.O3和SO2
参考答案:B
本题解析:A.CO和N2的原子个数都为2;价电子数:前者碳为4,氧为6,共为10,后者氮为5,2个氮共为10,原子数和价电子数都相等,属于等电子体,故A正确;
B.N2H4和C2H4的原子个数都为6;价电子数:前者氮为5,氢为1,共为14,后者碳为4,氢为1,共为12,原子数相等,但价电子数不相等,不属于等电子体,故B错误;
C.CO2和N2O的原子个数都为3;价电子数:前者碳为4,氧为6,共为16,后者氮为5,氧为6,共为16,原子数和价电子数都相等,属于等电子体,故C正确;
D.O3和SO2的原子个数都为3;价电子数:前者氧为6,共为18,后者硫和氧都为6,共为18,原子数和价电子数都相等,属于等电子体,故D正确;
故选B。
点评:本题考查了等电子体,解答本题关键是充分理解等电子体的本质特征,难度中等。
本题难度:简单
5、选择题 在下列粒子半径的比较中,正确的是( )
A.Na+>Na
B.Cl->Cl
C.Ca2+>Cl-
D.Mg>Na
参考答案:B
本题解析:阳离子的半径比其原子半径小,阴离子半径比其原子半径大,所以A错B对;Ca2+和Cl-均具有和Ar原子相同的电子层结构,因Ca2+的核电荷数大,故半径Ca2+<Cl-,C错误;Mg和Na的原子核外电子层数相同,Mg的核电荷数大于Na,则Mg的原子半径小于Na,D错误。
本题难度:一般