微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如图所示.则下列说法正确的是( )
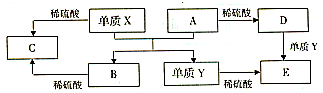
A.x与A反应的化学方程式是:Al2O3+2Fe
Fe2O3+2A
B.检验D溶液中的金属阳离子的反应:Fe3++3SCN-=Fe(SCN)3↓
C.单质Y在一定条件下能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
参考答案:C
本题解析:
本题难度:简单
2、填空题 已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:?
粒子代码
| a
| I
| e
|
原子核数
| 单核
| 四核
| 双核
|
粒子的电荷数
| 一个单位正电荷
| 0
| 一个单位负电荷
|
物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:

请填写下列空白:?
(1)写出下列物质的化学式:B?,J?。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M
?。?
②I溶于G
?。?
(3)在通常状况下,若1 g C气体在B气体
中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为?。
参考答案:(1)Cl2 ?NO?
(2) ①H+ +ClO-= HClO?②NH3+H2O NH3·H2O
NH3·H2O NH4++OH-? (3)2HCl(g)=H2(g)+Cl2(g);△H=" +184.6" kJ·mol-1?
NH4++OH-? (3)2HCl(g)=H2(g)+Cl2(g);△H=" +184.6" kJ·mol-1?
本题解析:要求学生熟练掌握常见10电子的微粒,熟悉常见化学工业生产重要反应。
本题难度:一般
3、推断题 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)。
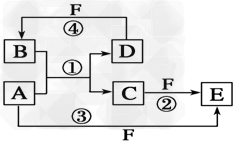
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则C的电子式为_________________,反应④的化学方程式为________________________。
(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行。请写出在水溶液中进行的反应②的离子方程式_______________;已知光照条件下D与F反应生成B,写出该反应的化学方程式:_________________。
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为_________________。
参考答案:(1)“略”;C+4HNO3(浓)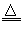 CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(2)2Fe2++Cl2==2Fe3++2Cl-;H2+Cl2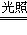 2HCl
2HCl
(3)2C+SiO2 Si+2CO↑
Si+2CO↑
本题解析:
本题难度:一般
4、填空题 (12分)下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写出有关物质的名称或化学式:F?,H?。
若反应①是在加热条件下进行,则A是?;若反应①是在常温条件下进行,则A是?。
(2)写出B与MnO2共热获得D的离子方程式? ?。
?。
(3 )B的稀溶液与AgNO3溶液混合可形成沉淀AgX,此沉淀的Ksp(AgX) =1.8×10-10。将等体积的B稀溶液与AgNO3溶液混合,若B的浓度为2×10—4
)B的稀溶液与AgNO3溶液混合可形成沉淀AgX,此沉淀的Ksp(AgX) =1.8×10-10。将等体积的B稀溶液与AgNO3溶液混合,若B的浓度为2×10—4 mo1/L
mo1/L  ,则生成沉淀所需AgNO3溶液的最小浓度为________。若向AgX悬浊液中滴加KI溶液,观察到的现象?,沉淀能够发生转化的原因是?。
,则生成沉淀所需AgNO3溶液的最小浓度为________。若向AgX悬浊液中滴加KI溶液,观察到的现象?,沉淀能够发生转化的原因是?。
参考答案:

本题解析:略
本题难度:一般
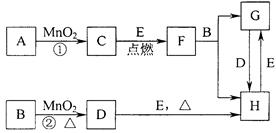
5、填空题 A、B、C、D、G?都是含有同一种短周期元素的化合物,E?是氧化物,H?是单质.根据如图转化关系(反应条件及部分产物已略去)填空:
(?l?)若A、B、C、D、G?均含X?元素,且A的一个分子中只含有10?个电子,G?是复合肥料,则反应①、②、③是工业生产______的基本原理,M?的化学式是______.其中反应①的化学方程式是______;反应④的离子方程式是______.
(?2?)若A、B、C、D、G?均含Y元素,Y元素处于X的相邻周期、相邻族,G?可作净水剂,则反应①、②、③是工业生产______的基本原理,M?元素在周期表中的位置是______.其中反应①的化学方程式是______;反应①一⑤中,既属于化合反应又属于非氧化还原反应的是______.
参考答案:(1)E是氧化物,由A和R反应生成,则R应为O2,A的一个分子中只含有10个电子且能连续氧化,则A为NH3,B是NO,E是H2O,C是NO2,D是HNO3;由于G是复合肥料,只能是KNO3,故F为KOH,H为H2,M为K.则反应①、②、③是工业生产硝酸的重要反应,其中反应①的化学方程式是4NH3+5O2催化剂.△4NO+6H20,反应④是铜和稀硝酸的反应,其离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:硝酸;?K(或K2O2、KO2);4NH3+5O2催化剂.△4NO+6H20;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;?
(2)Y元素处于X的相邻周期、相邻族,说明Y元素是S元素,位于第3周期ⅢA族,故B为SO2,C为SO3,D为H2SO4,反应①是工业生产硫酸的反应,可推知A为FeS2,E为Fe2O3,反应方程式为:4FeS2+11O2?高温?.?2Fe2O3+8SO2;G可作净水剂,为Al2(SO4)3,M为Al,Al位于第3周期ⅢA族,H为Fe,F为Al2O3,在以上反应中C→D的反应为S03+H20═H2SO4,为非氧化还原反应,故答案为:硫酸;第3周期ⅢA族;4FeS2+11O2?高温?.?2Fe2O3+8SO2;③.
本题解析:
本题难度:一般