微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 下列转化关系图中,A、B、C、D、E常温下为气体,B、E、F、K为单质,其中F为黑色固体;C、D均能使澄清的石灰水变混浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物.请回答下列问题:
(1)E的电子式为______.
(2)反应③的离子方程式为______.
(3)F与G的溶液反应的化学方程式为______.
(4)检验溶液L中金属阳离子的方法是______.
(5)气体A的密度为相同状况下氢气密度的30倍,且A中含3种组成元素,通过计算、推理,可确定A的分子式为______(此分子式中元素符号书写次序按从左往右元素原子序数“大小中”顺序排列);A分子中各原子均达8电子稳定结构,则其结构式为______.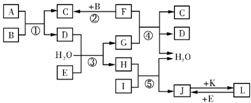
参考答案:C、D均能使澄清的石灰水变混浊,能使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,所以C、D属于二氧化碳和二氧化硫;E为单质,D、E均能使品红溶液褪色,能使品红溶液褪色的有氯气和二氧化硫,所以D是二氧化硫,C是二氧化碳,E是氯气;I是一种红棕色固体氧化物,I是氧化铁;B、F为单质,其中F为黑色固体,F和B反应生成二氧化碳,所以F是碳,B是氧气;A和氧气反应生成二氧化碳和二氧化硫,所以A是;氯气和水、二氧化硫反应生成硫酸和盐酸,碳和硫酸反应,所以G是硫酸,H是盐酸;盐酸和氧化铁反应生成氯化铁和水,所以J是氯化铁;K为单质,J和K反应生成L,L和氯气反应生成氯化铁,所以L是氯化亚铁,K是铁.
(1)E是氯气,E的电子式为:
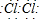
.
故答案为:
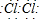
.
(2)氯气和二氧化硫、水反应生成硫酸和盐酸,离子反应方程式为:Cl2+SO2+2H2O=2Cl-+SO42-+4H+.
故答案为:Cl2+SO2+2H2O=2Cl-+SO42-+4H+
(3)碳和硫酸在加热条件下反应生成二氧化硫和二氧化碳、水,
反应方程式为:C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O.
故答案为:C+2H2SO4(浓)?△?.?CO2↑+2SO2↑+2H2O.
(4)二价铁离子的检验方法是:向溶液中滴加KSCN溶液,溶液不变成红色,滴加氯水后,溶液变红色就证明有二价铁离子存在.
故答案为:向溶液中滴加KSCN溶液,溶液不变成红色,滴加氯水后,溶液变红色.
(5)气体A的密度为相同状况下氢气密度的30倍,所以A的相对分子量是氢气的30倍,即A的相对分子量为60,且A中含3种组成元素,通过以上分析A中一定含有硫和碳元素,且A和氧气反应后生成二氧化硫和二氧化碳,所以A含有氧元素,分子式为SCO;A分子中各原子均达8电子稳定结构,则其结构式为S=C=O.
故答案为:SCO;S=C=O.
本题解析:
本题难度:一般
2、填空题 (9分)A~H是由短周期元素组成的单质或化合物,其中A是淡黄色固体化合物,B是生活中最常见的无色液体,D是地壳中含量最多的金属元素的单质,F是典型的两性氧化物。它们之间的转化关系如下(部分生成物已略去):

请回答下列问题
⑴写出下列物质的化学式:A?、B?、C?、 E?
⑵写出C+D→F的化学方程式:?;
⑶G→H的反应过程中能观察到有?色的沉淀生成;H→G的离子方程式是:
?。
参考答案:(1)Na2O2? H2O? O2? NaOH?(2)4Al + 3O2 2Al2O3
2Al2O3
(3)白? Al(OH)3 + 3H+ = Al3+ + 3H2O
本题解析:A是淡黄色固体化合物,则A是Na2O2,B是生活中最常见的无色液体,则B是H2O,D是地壳中含量最多的金属元素的单质,则D是Al,F是典型的两性氧化物,则F是Al2O3,所以C是O2,G是AlCl3,H是Al(OH)3。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合.它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法.。解框图题的方法:最关键的是寻找"突破口"!,"突破口"就是抓"特"字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
3、推断题 下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。
?
请按要求填空: 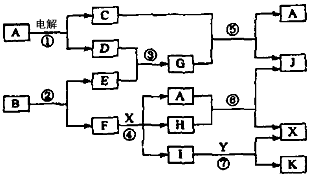
(1)写出下列物质的化学式:A_________,E_________,F_________,Y_________。
(2)反应⑤的化学方程式为:_______________________。
(3)1molB通过反应②得到1molF,B中F的质量分数为72%,则B的化学式为:__________________。
参考答案:(1)H2O;N2;Ag;HCl
(2)4NH3+5O2 4NO+6H2O
4NO+6H2O
(3)AgN3
本题解析:
本题难度:一般
4、推断题 A.J是日常生活中常见的两种金属,这两种金属和NaOH溶液组成原电池,A作负极;?F常温下是气体,各物质有以下的转化关系(部分产物及条件略去)。?

请回答以下问题:? ?
(1)写出原电池的负极反应方程式________________
(2)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为_____________(写出计算式);相同条件下,等浓度的C溶液与CH3COONa溶液中,C的阴离子与CH3COO-浓度的大小关系:前者___________?后者(用“>”、“<”或“=”表示)。 ?
(3)写出②的化学方程式_____________?
(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色的钴玻璃观察火焰呈紫色。
①X的水溶液与NaHCO3溶液混合,反应的离子方程式为_________
②500mLX的溶液与Ba(OH)2反应生成沉淀的质量与加入Ba(OH)2物质的量的关系如图:?
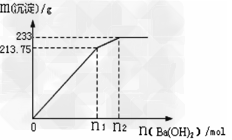
请回答:X晶体的俗名为___________;其溶液的物质的量浓度为__________?mol/L。
参考答案:(1)Al+4OH--3e- = AlO2-+2H2O?
(2)10-2-10-12 mol/L或c(OH-)-c(H+)?;<?
(3)4NH3+5O2 4NO+6H2O?
4NO+6H2O?
(4)①Al3++3HCO3- = Al(OH)3↓+3CO2↑? ;? ②明矾 ;1mol/L
本题解析:
本题难度:一般
5、填空题 (12分)现有物质A~I,其转化关系如下图,已知:A为两种元素组成的化合物,B不溶于水,X常温下为无色液体,E常温下为红棕色气体。(部分反应条件及生成的其它物质已略去)
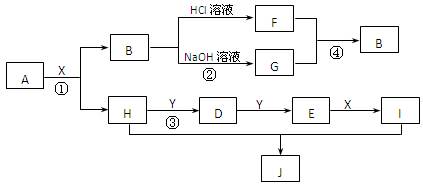
根据上述转化关系图回答:
(1)写出下列物质的化学式 X?;J?
(2)物质H的电子式:?;
物质J属于哪种晶体类型:? ?。
?。
(3)写出反应①的化学方程式?;
写出反应④的离子方程式?。
参考答案:(12分)
(1)H2O;? NH4NO3?(2)NH3电子式?;?离子晶体
(3)AlN+3H2O=Al(OH)3+NH3?; Al3++3AlO2 -+6H2O="4" Al(OH)3
-+6H2O="4" Al(OH)3
本题解析:略
本题难度:一般