| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《未知》高频试题强化练习(2017年最新版)(二)
(4)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:_______ FeO42-+_______ H2O="_______" Fe(OH)3(胶体)+_______O2↑+_______OH-。 (5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示。电解过程中阳极的电极反应式为________。 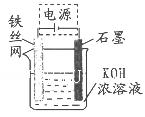 (6)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:3Zn(OH)2+2Fe(OH)3+4KOH-----3Zn+2K2FeO4+8H2O,放电时电池的负极反应式为________ 。 参考答案:(1)2OH-+Cl2=ClO-+Cl-+H2O?(2) AC ?(3) 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O?0.45 本题解析:(l) KOH溶液与足量Cl2发生反应的离子方程式为2OH-+Cl2=ClO-+Cl-+H2O。(2)在溶液I中加入KOH固体的目的是为下一步反应提供碱性的环境;与溶液I中过量的Cl2继续反应,生成更多的KClO。故选项为A. C.(3) 反应③中发生的离子反应方程式为2Fe3++3ClO-+10OH-=2FeO42-+ Cl-+5H2O .在方程式中每产生2mol的FeO42-转移电子6mol.消耗氧化剂3mol.现在n(K2FeO4)= 59.4g÷198g/mol=0.3mol所以消耗氧化剂的物质的量为3÷2×0.3mol=0.45mol.(4) 高铁酸钾(K2FeO4)水解的离子方程式为4FeO42- +10H2O 本题难度:一般 2、选择题 对反应Zn+2HNO3+NH4NO3=N2↑+3H2O+Zn(NO3)2的下列说法中正确的是(?) 参考答案:B 本题解析:本题以中学化学课本里几类典型而又重要的反应为背景,意在对氧化还原反应的本质和特征及及其与其它各型反应间的关系作基础性考查。其中,只有铝热反应铁定是置换反应,一定有元素化合价的升降,可逆反应则不一定,皂化反应和中和反应一定无元素化合价的升降。 本题难度:简单 3、选择题 现有含0.1 mol/L的SO32-溶液30 mL,恰好被2×10-3 mol XO4-氧化为SO42-,则元素X在还原产物中的化合价是 参考答案:A 本题解析:根据氧化还原反应中得失电子守恒计算。根据题意知,该反应中SO32-为还原剂,SO32-被氧化,为SO42-,化合价从+4升到+6价失电子数=0.1mol/L×0.03L×2=0.006mol,XO4-为氧化剂,X元素化合价降低,设元素X在还原产物中的化合价为n,根据得失电子守恒得2×10-3 mol(7—n)=0.006mol,解得n=4,选A。 本题难度:一般 4、选择题 10mL? 0.05mol/L含有R2O72-离子的浓溶液恰好能将10mL 0.05mol/L的Fe2+溶液完全氧化,则元素R在还原产物中的化合价为? (? ) 参考答案:C 本题解析:略 本题难度:简单 5、选择题 某溶液中阳离子只含K+,其中Cl-、Br-、I-的个数比为1∶2∶3,欲使这些离子个数比变为3∶2∶1,需要通入的氯分子与原溶液中I-的个数比应为(? ) 参考答案:C 本题解析: Br-和I-还原性强弱关系是:I->Br-由于还有未反应的I-,所以氯气只和I-发生反应。根据反应方程式:Cl2+2I-=2Cl-+I2反应的碘离子物质的量2mol,消耗的氯气是1mol .所以需要通入的氯分子与原溶液中I-的个数比应为1:3.选项为:C。 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《物质的量》.. | |