微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将Fe和Cu的混合粉末加入到100 mL 4 mol/L稀硝酸中充分反应后:
(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是?,可能有的阳离子是?。
(2)若反应后的溶液中有Fe3+,则溶液中一定含有的阳离子是?,可能含有的阳离子是?。
(3)如果反应后的溶液中无金属剩余,则加入的金属质量最大为?。
(4)如果加入的Fe和Cu的质量比为7∶8,则使HNO3完全反应的金属最小质量为?。
参考答案:(1)Fe2+ Cu2+
(2)Cu2+ Fe2+或H+
(3)9.6 g
(4)7.2 g
本题解析:本题中要注意的是稀HNO3将铁和铜氧化时的反应顺序:①与Fe反应生成Fe3+;②与Cu反应生成Cu2+;③Fe3+与Fe反应生成Fe2+。(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是Fe2+,可能有的阳离子是Cu2+;(2)若反应后有Fe3+,则此溶液中一定有的阳离子是Cu2+,可能有的阳离子是Fe2+或H+,而这两者不能同时大量存在;(3)由上述的三个过程可知,只发生与铜的反应时所需的金属质量是最大的,由3Cu~8HNO3可解得需Cu的质量最大为9.6 g;(4)因要求金属质量要最小,所以加入的铁要尽量多地耗酸,所以生成的是Fe3+,加入的Fe与Cu的质量比为7∶8,得到两者的物质的量之比为1∶1,根据Fe~4HNO3,3Cu~8HNO3可解得需金属的物质的量各为0.06 mol,从而可得金属的质量为7.2 g。
本题难度:一般
2、选择题 将a g二氧化锰粉末加入b mol·L-1的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是(?)
A.可以收集到氯气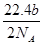 L
L
B.反应后溶液中的Cl-数目为2aNA/87
C.NA可表示为
D.反应后溶液中的H+数目为(bc-2d)
参考答案:C
本题解析:A项,V(Cl2)=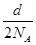 ×22.4 L,A错;B项,(bcNA-d)个,错误;C项,
×22.4 L,A错;B项,(bcNA-d)个,错误;C项,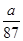 ×2×NA=d,NA=
×2×NA=d,NA= ,正确;D项,考虑到浓盐酸的挥发,无法计算溶液中H+的数目。
,正确;D项,考虑到浓盐酸的挥发,无法计算溶液中H+的数目。
本题难度:一般
3、选择题 将m g的铜放入足量的稀硝酸中充分反应后,生成n L(标准状况)一氧化氮,被还原的硝酸为(?)
①63n/22.4 g; ②n/22.4 g; ③m/96 mol; ④42m mol
A.①④
B.①③
C.②④
D.②③
参考答案:B
本题解析:铜和稀硝酸的反应方程式:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O?可以看到:被还原的硝酸的物质的量等于一氧化氮的物质的量即n(HNO3)被还原=n(NO)=n/22.4? mol?; 所以m(HNO3)被还原="63n/22.4" g;从铜和被还原的硝酸是定量关系得: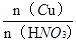 =
=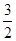 ?所以n(HNO3)被还原="m/96" mol 故选B。
?所以n(HNO3)被还原="m/96" mol 故选B。
点评:本题考查的是铜和硝酸反应的计算,铜和硝酸的反应需要注意其间定量关系,尤其是是做氧化剂的部分。
本题难度:一般
4、简答题 按要求回答问题
①配平下面的化学方程式,并标明电子转移的方向和数目
______Fe+______?HNO3=______?Fe(NO3)3+______NH4NO3+______H2O
②该反应中被还原的HNO3与未被还原的HNO3的物质的量之比为______.如有1molHNO3被还原,则转移电子______mol,生成NH4NO3质量为______g.
③上述反应的产物NH4NO3受热分解生成N2、H2O、HNO3,该分解反应中氧化产物与还原产物的质量比为______.
④Fe(NO3)3溶液能使淀粉碘化钾试纸变蓝色,写出该反应的离子方程式______.
参考答案:①该反应中铁元素的化合价变化为0→+3,所以一个铁原子失去3个电子,氮元素的化合价变化为+5→-3,所以一个参加氧化还原反应的硝酸根离子得到8个电子,所以得失的最小公倍数是24,所以铁的计量数是8,硝酸铵的计量数是3,其它元素根据原子守恒进行配平,所以该方程式为:8Fe+30HNO3=8?Fe(NO3)3+3 NH4NO3+9 H2O.
故答案为:8;30;8;3;9.
②8Fe+27?HNO3+3HNO3(氧化剂)=8?Fe(NO3)3+3 NH4NO3+9 H2O.
所以被还原的硝酸和未被还原的硝酸物质的量之比=3:27=1:9;
设转移电子为xmol;生成硝酸铵的质量为yg.
8Fe+27?HNO3+3HNO3(氧化剂)=8?Fe(NO3)3+3 NH4NO3+9H2O?转移电子?
?3mol?240g?24mol
? 1mol? yg?xmol
x=8,y=80
故答案为:1:9;8;80.
③硝酸铵分解的方程式为:5NH4NO3?△?.?4N2↑+9H2O+2HNO3,该反应中氧化产物和还原产物都是氮气,一个铵根离子失去3个电子生成,一个参加氧化还原反应的硝酸根离子得到5个电子,得失电子的最小公倍数是15,所以铵根离子的个数与参加氧化还原反应的硝酸根离子的个数是5:3,所以氧化产物和还原产物的质量之比为5:3.
故答案为:5:3.
④铁离子有氧化性,碘离子有还原性,所以铁离子和碘离子能发生氧化还原反应;Fe(NO3)3溶液能使淀粉碘化钾试纸变蓝色,说明有碘单质生成,同时铁离子被还原成二价铁离子,所以发生的离子方程式为2Fe3++2I-=2Fe2++I2.
故答案为:2Fe3++2I-=2Fe2++I2
本题解析:
本题难度:一般
5、选择题 Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量为2∶1时,则反应中Cu2S与被还原的HNO3的物质的量之比为(?)
A.1∶6
B.1∶7
C.1∶8
D.1∶9
参考答案:A
本题解析:Cu2S与一定浓度的HNO3反应中,Cu2S中铜元素由+1价被氧化为+2价、硫元素由-2价被氧化为+6价,硝酸起氧化剂与酸的作用,起氧化剂作用HNO3中氮元素被还原为NO2和NO,起酸作用的硝酸生成Cu(NO3)2。令NO2和NO的物质的量分别为2mol、1mol,根据电子转移守恒可知:
n(Cu2S)×[6-(-2)+1×2]=2mol×(5-4)+1mol×(5-2),解得n(Cu2S)=0.5mol。故反应中Cu2S与被还原的HNO3的物质的量之比为1:6。
本题难度:一般