| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》考点特训(2017年冲刺版)(四)
参考答案: 本题解析: 本题难度:一般 2、选择题 常温下a mol/L 稀氨水和b mol/L 稀盐酸等体积混合,对混合后溶液判断一定正确的是 |
参考答案:
本题解析:
本题难度:一般
3、选择题 常温下,pH=12的氢氧化钠溶液和pH=4的醋酸溶液等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是
A.混合前的醋酸约1%发生电离
B.混合后的溶液中c(Na+)=c(CH3COO-)
C.氢氧化钠和醋酸的浓度不相等
D.混合后的溶液呈中性
参考答案:A
本题解析:试题分析:A、醋酸是弱酸,存在电离平衡,pH=4的醋酸溶液中氢离子浓度是10-4mol/L。常温下,pH=12的氢氧化钠溶液和pH=4的醋酸溶液等体积混合后恰好中和,这说明醋酸浓度等于强碱氢氧化钠的浓度,即醋酸的浓度是10-4mol/L,所以混合前的醋酸约有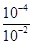 ×100%=1%发生电离,A正确;B、恰好反应时生成醋酸钠,CH3COO-水解,溶液显碱性,因此根据电荷守恒可知,溶液中离子浓度大小关系是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),B不正确;C、氢氧化钠和醋酸的浓度相等,都是10-2mol/L,C不正确;D、混合后的溶液呈碱性,D不正确,答案选A。
×100%=1%发生电离,A正确;B、恰好反应时生成醋酸钠,CH3COO-水解,溶液显碱性,因此根据电荷守恒可知,溶液中离子浓度大小关系是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),B不正确;C、氢氧化钠和醋酸的浓度相等,都是10-2mol/L,C不正确;D、混合后的溶液呈碱性,D不正确,答案选A。
考点:考查醋酸与氢氧化钠溶液中和后溶液酸碱性判断以及离子浓度大小比较
本题难度:困难
4、选择题 下列说法正确的是
A.干冰升华要吸收大量的热,这就是化学反应中的吸热反应
B.凡是在加热或点燃条件下进行的反应都是吸热反应
C.人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时所放出的能量
D.明矾有净水作用,所以用明矾处理硬水,可以使硬水软化
参考答案:C
本题解析:
A、干冰升华是物理变化,不属于吸热反应,故A错误;
B、有些放热反应也需要一定的引发条件才能进行,如氢气在氧气中燃烧需要点燃,故B错误;
C、氢气和氧气化合时所放出的大量的能量,可焊接或切割金属,故C正确;
D、明矾可以净水,其净水原理是铝离子水解形成氢氧化铝胶体吸附悬浮颗粒,不能吸附溶于水的钙、镁离子,故不能软化水,故D错误。
考点:考查化学反应中能量的变化、明矾净水的原理
点评:本题考查了化学反应中能量的变化、明矾净水的原理,难度不大。注意掌握常见的放热反应和吸热反应。
本题难度:一般
5、选择题 下列各溶液中,各粒子的物质的量浓度关系正确的是
A.0.1mol/LNa2CO3溶液中:c(Na+) + c(H+) = c(CO32-) + c(HCO3-) + c(OH-)
B.0.1mol/L(NH4)2SO4溶液中:c(SO42-) > c(NH4+) > c(H+) > c(OH-)
C.0.1mol/LNaHCO3溶液中:c(OH-) = 2c(H2CO3) + c(HCO3-) + c(H+)
D.0.1mol/LNa2S溶液中:c(Na+) = 2c(S2-) +2c(HS-) + 2c(H2S)
参考答案:D
本题解析:A.根据电荷守恒可得c(Na+) + c(H+) =2c(CO32-) + c(HCO3-) + c(OH-)。错误。B.在0.1mol/(NH4)2SO4溶液中存在电离:(NH4)2SO4="2" NH4++ SO42-,所以c(NH4+) >c(SO42-);由于该盐是强酸弱碱盐,NH4+水解消耗水电离产生的OH-,破坏了水的电离平衡,最终使溶液显酸性,c(H+) > c(OH-),但是弱电解质的电离作用远小于盐的电离,c(SO42-) >c(H+)所以在溶液中两种浓度关系为:c(NH4+) >c(SO42-)>c(H+)> c(OH-)。错误。C.在0.1mol/LNaHCO3溶液中根据质子守恒可得:c(OH-) = c(H+) +c(H2CO3) -c(CO32-)。错误。D.在0.1mol/LNa2S溶液中,根据物料守恒可得:c(Na+) = 2c(S2-) +2c(HS-) + 2c(H2S)。正确。
考点:考查离子浓度的大小比较的知识。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《离子共存》.. | |