|
|
|
高考化学知识点总结《盐类水解的原理》考点特训(2017年冲刺版)(五)
2017-07-27 09:46:23
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在10 mL 0.1 mol/L NaOH溶液中加入等体积、等浓度的CH3COOH溶液,反应后溶液中各粒子的浓度关系错误的是
A.C(Na+)>C(CH3COO-)>C(H+)>C(OH-)
B.C(Na+)>C(CH3COO-)>C(OH-)>C(H+)
C.C(Na+)= C(CH3COO-)+C(CH3COOH)
D.C(Na+)+ C(H+)= C(CH3COO-)+C(OH-)
|
2、填空题 (13分)(1)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,热化学方程式为
(2)已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成液态水放出571.6kJ的热量,表示氢气燃烧热的热化学方程式是
(3)Na2CO3等溶液不能存放在磨口玻璃塞的试剂瓶中,其原因是(结合离子方程式说明): ;把三氯化铁溶液蒸干并充分灼烧,最后得到的固体产物是(化学式) ;相关反应的方程式是: 、 ;配制FeCl2溶液时,应加入 ,以抑制Fe2+的水解,还应加入少量铁粉,目的是: 。
3、选择题 常温下,将NaHY晶体加入水中溶解,得到0.1 mol/L NaHY溶液,下列叙述正确的是( )
A.若NaHY溶液的pH=4,该溶液中粒子浓度关系为:c(Na+)>c(HY-)>c(H+)>c(Y2-)>c(H2Y)
B.若NaHY的水溶液显碱性,该溶液中粒子浓度关系为:c(Na+)>c(OH-)>c(H+)>c(HY-)
C.若溶液中粒子浓度关系为c(H+)+c(H2Y)=c(OH-)+c(Y2-),则NaHY的水溶液一定显碱性
D.将NaHY晶体加入水中一定能促进水的电离
|
4、选择题 下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=3的H2SO4溶液中:c(H+)=10-3mol·L-1
B.呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)>c(CH3COO-)
C.在Na2CO3溶液中,2c(Na+)= c(CO32-)+ c(HCO3-) + c(H2CO3)
D.氯化铵溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
5、填空题 物质在水溶液中存在的电离平衡、水解平衡和沉淀溶解平衡,都可看作化学平衡。请根据所学知识回答:
(1)在0.1mo1·L-1的NaHSO3溶液中存在的各种平衡体系为(用离子方程式表示): 、 、 。
已知该溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO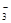 )>c(SO
)>c(SO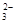 )>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .
)>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .
(2)常温下,某水溶液中存在的离子有:Na+、A—、H+、OH—,若该溶液由0.1mo1.L-1的HA溶液和0.1mol.L-1的NaOH溶液等体积混合而得,则溶液的pH (填“大于”、“小于”或“等于”)7,理由是 。
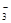 )>c(SO
)>c(SO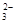 )>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .
)>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .