| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》考点特训(2017年冲刺版)(六)
参考答案:A 本题解析:10 mL 0.1 mol/L NaOH溶液中加入等体积、等浓度的CH3COOH溶液,酸碱恰好反应生成CH3COONa ,CH3COONa属于强碱弱酸盐,CH3COO-会水解导致溶液显碱性,CH3COO-浓度减小,所以反应后溶液中各粒子的浓度关系为C(Na+)>C(CH3COO-)>C(OH-)>C(H+),A项错误;B项正确;C项符合物料守恒,正确;D项符合电荷守恒,正确;选A。 本题难度:一般 2、填空题 (13分)(1)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,热化学方程式为 参考答案:(1) C(s)+ H2O(g) == CO(g) + H2(g)ΔH== +131.3KJ·mol—1 本题解析:热化学方程式的书写注意:①各物质后括号内注明聚集状态 本题难度:一般 3、选择题 常温下,将NaHY晶体加入水中溶解,得到0.1 mol/L NaHY溶液,下列叙述正确的是( ) |
参考答案:A
本题解析:A项,溶液pH=4,说明HY-电离程度大于水解程度,故c(Y2-)>c(H2Y),同时考虑水电离出H+,故c(H+)>c(Y2-),A正确;
B项,虽然溶液呈碱性,但OH-主要来源于HY-的水解反应,但水解反应的程度很微弱,故c(HY-)>c(OH-),B错误;
C项,由电荷守恒c(Na+)+c(H+)=2c(Y2-)+c(OH-)+c(HY-),物料守恒c(Na+)=c(HY-)+ c(Y2-)+c(H2Y),可得c(H+)+c(H2Y)=c(OH-)+c(Y2-),无法说明NaHY的水溶液为碱性,C错误;D项,若NaHY溶液呈酸性,则对水的电离起抑制作用,D错
本题难度:一般
4、选择题 下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=3的H2SO4溶液中:c(H+)=10-3mol·L-1
B.呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)>c(CH3COO-)
C.在Na2CO3溶液中,2c(Na+)= c(CO32-)+ c(HCO3-) + c(H2CO3)
D.氯化铵溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
参考答案:A
本题解析:A.H2SO4是强酸,完全电离,若H2SO4溶液pH=3,则c(H+)=10-3mol/L,正确;B.根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于醋酸和醋酸钠的混合溶液呈中性,所以c(H+)=c(OH-),故c(Na+)=c(CH3COO-),错误;C.在Na2CO3溶液中,根据物料守恒可得c(Na+)="2" c(CO32-)+ 2c(HCO3-) + 2c(H2CO3),错误;D.氯化铵是强酸弱碱盐,铵根离子水解消耗水电离产生的OH-,破坏了水的电离平衡,最终当溶液达到电离平衡时,c(H+)>c(OH-);根据物料守恒可得c(Cl-)=c(NH4+)+c(NH3·H2O),所以在氯化铵溶液中,:c(Cl-)>c(NH4+)>c(H+)>c(OH-),错误。
考点:考查溶液中离子浓度的大小比较的知识。
本题难度:一般
5、填空题 物质在水溶液中存在的电离平衡、水解平衡和沉淀溶解平衡,都可看作化学平衡。请根据所学知识回答:
(1)在0.1mo1·L-1的NaHSO3溶液中存在的各种平衡体系为(用离子方程式表示): 、 、 。
已知该溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO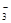 )>c(SO
)>c(SO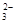 )>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .
)>c(H2SO3)。则该溶液中c(H+) c(OH-) (填“大于”、“小于”或“等于”),简述理由: .
(2)常温下,某水溶液中存在的离子有:Na+、A—、H+、OH—,若该溶液由0.1mo1.L-1的HA溶液和0.1mol.L-1的NaOH溶液等体积混合而得,则溶液的pH (填“大于”、“小于”或“等于”)7,理由是 。
参考答案:(1) H2O H++OH- ; HSO3-
H++OH- ; HSO3- H++SO32-; HSO3-+H2O
H++SO32-; HSO3-+H2O H2SO3+OH- ; 大于; 在NaHSO3溶液中存在HSO3-的电离(HSO3-
H2SO3+OH- ; 大于; 在NaHSO3溶液中存在HSO3-的电离(HSO3- H++SO32-)和水解(HSO3-+H2O
H++SO32-)和水解(HSO3-+H2O H2SO3+OH-),由题给信息c(SO32-)>c(H2SO3)知电离比水解程度大,所以c(H+)>c(OH-) (回答出电离大于水解即可);
H2SO3+OH-),由题给信息c(SO32-)>c(H2SO3)知电离比水解程度大,所以c(H+)>c(OH-) (回答出电离大于水解即可);
(2)大于或等于;若HA是强酸,pH=7,若HA是弱酸,pH>7。
本题解析:(1)在0.1mo1·L-1的NaHSO3溶液中存在的各种平衡体系有电离平衡:H2O H++OH- ; HSO3-
H++OH- ; HSO3- H++SO32-和水解平衡:HSO3-+H2O
H++SO32-和水解平衡:HSO3-+H2O H2SO3+OH-。由于在该溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),说明HSO3-电离作用大于水解作用。因为在溶液中在NaHSO3溶液中存在HSO3-的电离(HSO3-
H2SO3+OH-。由于在该溶液中有关微粒浓度由大到小的顺序为:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3),说明HSO3-电离作用大于水解作用。因为在溶液中在NaHSO3溶液中存在HSO3-的电离(HSO3- H++SO32-)和水解(HSO3-+H2O
H++SO32-)和水解(HSO3-+H2O H2SO3+OH-),由题给信息c(SO32-)>c(H2SO3)知电离比水解程度大,所以c(H+)>c(OH-)。(2)若HA为强酸,则c(H+)=c(OH-).溶液显中性,pH=7;若HA为弱酸,则c(H+)<c(OH-).溶液显碱性,pH>7。
H2SO3+OH-),由题给信息c(SO32-)>c(H2SO3)知电离比水解程度大,所以c(H+)>c(OH-)。(2)若HA为强酸,则c(H+)=c(OH-).溶液显中性,pH=7;若HA为弱酸,则c(H+)<c(OH-).溶液显碱性,pH>7。
考点:考查多元弱酸的酸式盐溶液中的平衡及离子浓度的大小比较、溶液的酸碱性的知识。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《离子共存》.. | |