微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuCl2?2H2O晶体。
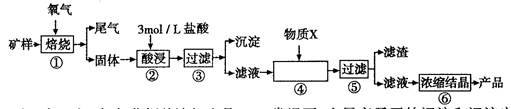
已知:在20℃时,氯化铜的溶解度是73g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
金属离子
| 开始形成氢氧化物沉淀的pH
| 完全形成氢氧化物沉淀的pH
|
Fe2+
| 7.0
| 9.0
|
Fe3+
| 1.9
| 3.2
|
Cu2+
| 4.7
| 6.7
|
回答下列问题:
(1)步骤①的焙烧过程中需要通入氧气。在实验室中使用中学化学常见物质、下图所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式

(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物。
若在实验室中以碱液吸收处理之,下列A、B、C装置中可行的是____(填字母);若选用甲装置,则烧杯中的下层液体可以是?
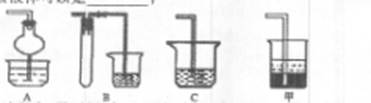
(3)步骤②酸浸过程中,需要用到3 mollL的盐酸l00mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有____;
(4)步骤④加入物质X的目的是?,物质X可以选用下列物质中的?;
A.氧化铜? B.稀盐酸? C.氨水? D.氧化亚铁
(5)在整个生产流程中,共需要进行?次过滤操作。
参考答案:(1)2H2O2 = 2H2O+O2↑,2Na2O2 + 2H2O= 4NaOH+O2↑
(2)AB?四氯化碳
(3)100ml容量瓶、量筒
(4)调节溶液的pH,使Fe3+以Fe(OH)3沉淀的形式析出? A
(5)3
本题解析:(1)根据装置图可知是固液不加热制气体,所以用H2O2和Na2O2来制取O2反应方程式为:2H2O2 = 2H2O + O2 ↑,2Na2O2 + 2H2O ="4NaOH" + O2 ↑
(2)尾气中含有的是SO2,SO2为酸性氧化物,极易溶于水,可由碱液吸收,但易形成倒吸,故可采用AB装置防倒吸:A中的干燥管可缓冲倒吸、B装置中的试管可做安全瓶;
若选用甲装置,可采用密度大于水的有机溶剂,例如四氯化碳,也可起到防倒吸的作用
(3)配制盐酸一般采取稀释的方法,用量筒量取一定的浓盐酸;
还需要选用100 mL容量瓶的容量瓶进行配制
(4)根据氢氧化物开始沉淀和完全沉淀的pH可知,只要调节pH值,就可以Fe3+以Fe(OH)3沉淀的形式析出,达到除杂的目的。为了不引入新杂质,还能调节pH值,所以选铜的难溶物,如CuO、Cu(OH)2、CuCO3等
(5)除了图示的两次过滤操作外,对CuCl2浓缩结晶后,还需要过滤才可得到产品,故共需要三次过滤操作
本题难度:一般
2、选择题 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液(选项中括号内)。挤压滴管的胶头部分,打开止水夹不会发生喷泉现象的是

A.NO(H2O含石蕊)
B.NH3(H2O含酚酞)
C.SO2 (NaOH溶液)
D.HCl(NaCl溶液)
参考答案:A
本题解析:略
本题难度:一般
3、实验题 根据以下各物质间的转化关系回答有关问题。
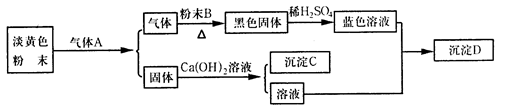
(1)B、C、D的化学式依次为_____________、___________、____________。
(2)A的电子式为_______,它属于___________(填“极性”或“非极性”)分子。
(3)淡黄色粉末与气体A反应的化学方程式为___________________________;黑色固体与稀硫酸反应的离子方程式为_________________________________。
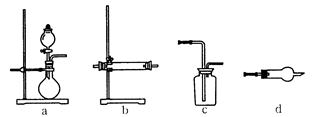
(4)右图为中学化学实验室常用的部分装置或仪器,请填写有关空白。
①淡黄色粉末与气体A的反应,可以选择在上述装置_______
(填字母代号,下同)中进行;气体与粉末B的反应可选用上述装置中的_______作反应发生装置。
②实验室通常用沉淀C和_______________反应制取气体A;制取时的反应装置应选用上述装置中的______________;若要用浓硫酸干燥制得的气体A,应选用上述装置中的__________作干燥装置。
③请写出装置d在中学化学实验中的可能用途(写出两条即可)______________
________________________________________________________________________________________________________________________________________.
参考答案:(1)Cu? CaCO3? Cu(OH)2?
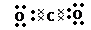
(2)?非极性?
(3)2Na2O2+2CO2 ="==" 2Na2CO3 + O2↑? CuO + 2H+ ="==" Cu2++H2O?
(4)① b、d? b?②稀盐酸? a? c?③反应器、干燥器、防倒吸装置等。
本题解析:黄色固体考虑为过氧化钠,蓝色溶液为硫酸铜。二氧化碳制取装置,用浓硫酸进行干燥,长进短出。
本题难度:一般
4、实验题 为了证明化学反应有一定的限度,进行了如下探究活动:
探究活动一:取5mL0.1?的KI溶液于试管,滴加0.1?的FeCl3溶液5~6滴,振荡;
探究活动二:在上述试管中加入2mLCCl4,充分振荡、静置;
探究活动三:取上述静置分层后的上层水溶液于试管,滴加0.1?的KSCN溶液5~6滴,振荡。
(1)探究活动一和探究活动二的实验现象分别为_______、_________。写出探究活动一中的反应的离子方程式___________________。
(2)在探究活动三中,实验者的意图是通过生成血红色的Fe(SCN)3,来验证有Fe3+残留,从而证明化学反应有一定的限度。但在实验中,却未见溶液呈血红色,对此同学们提出了下列两种猜想:
猜想一:KI溶液过量,Fe3+已全部转化为Fe2+
猜想二:生成Fe(SCN)3浓度极小,肉眼无法观察其颜色
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大。
信息二:Fe3+可与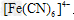 反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。结合新信息,请你设计以下实验验证猜想:
反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。结合新信息,请你设计以下实验验证猜想:
①各取2mL“探究活动三所得溶液”于试管A、B,请将相关的实验操作、预期现象和结论填入下表:
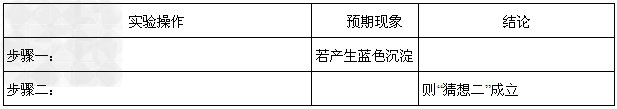
②写出操作“步骤一”中发生反应的离子方程式:_____________________。
参考答案:(1)溶液呈棕黄色;溶液分为两层,下层CCl4层呈紫色;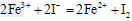
(2)①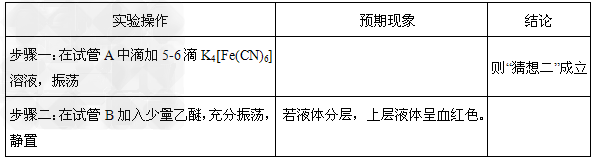 ②
②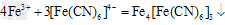
本题解析:
本题难度:一般
5、实验题 (15分) 在呼吸面具和潜水艇中可用过氧化钠作供氧剂,某课外活动小组设计了如下实验装置,以证明过氧化钠可作供氧剂。装置A、B、C中盛装的试剂,可供选择的为:饱和NaHCO3溶液、CaCO3固体、NaOH溶液、1.95 g Na2O2固体。 据下述装置回答问题:

(1)A中发生反应的离子方程式为?。
(2) B瓶的作用是?,反应的离子方程式?。?
(3)若D中的石灰水出现出现轻微白色浑浊,请说明原因:?___________________________________________________________________________。
(4)反应完毕时,若测得E中的集气瓶收集到的气体为250 mL,又知氧气的密度为1.43g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值?(答大或小),相差约?mL(取整数值,所用数据均在标准状况下测定),这是由于? ____________________________________________。

(5)为了使装置D部分更安全、合理,可将装置D改为下列?装置(用甲、乙、丙回答)
6)实验完毕,欲测定C中固体混合物含Na2CO3的质量分数,实验步骤如下,完成以下实验步骤中的空白。
若称取a g C中固体溶于一定量的水中,加入足量BaCl2溶液;过滤;?;
?;称量得b g固体,则Na2CO3的质量分数为?。
参考答案:(1)CaCO3 + 2H+ ="=" Ca2+ + CO2↑+ H2O; (2 分)
(2)吸收CO2中混有的HCl(1分); HCO3- + H +="=" CO2↑+ H2O (2分)
(3)C中有部分CO2未参加反应,流入D中生成沉淀 (1分)
(4)小;30;Na2O2未CO2反应完全;(3 分,各1分)
(5)乙 (2 分)?(6)洗涤(1分);干燥(1分);106 b/ 197a (2分)
本题解析:略
本题难度:简单