|
高考化学知识点总结《物质组成与性质实验方案的设计》在线测试(2017年最新版)(二)
2017-07-27 10:05:50
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 一般测定样品中成分含量的实验应重复二至三次。为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:
I.甲同学的方案如图所示:

(1)根据甲同学的实验装置图分析,在每次实验过程中所进行的称量操作至少要进行??次。
(2)甲同学重复测定了三次,得到碳酸钠的质量分
数的数据存在较大的偏差,你认为原因可能是?(填序号)。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置外空气中的水蒸气和二氧化碳被碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
D.加入稀硫酸的量不足,则可能造成误差
| II.乙同学的方案是:称取样品m g,并溶解,加过量氯化钡溶液,过滤、洗涤、烘干,
称量得固体n g。
(1)混合物中碳酸钠的质量分数为(用m、n表示) ?。
(2)洗涤沉淀的操作要点是?。
(3)Ca2+、Ba2+都可以使CO32-沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液的原因是?;测定CO32-的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是?。
参考答案:Ⅰ(1)4? (2).ABCD? Ⅱ (1).106n/197m? (2)沿玻璃棒向过滤器中的沉淀加水至淹没沉淀,静置使其全部滤出,重复2~3次?(3)生成微溶的氢氧化钙;碳酸钡相对分子质量比碳酸钙大,故生成的碳酸钡质量多,测定的相对误差小
本题解析:略
本题难度:简单
2、实验题 某研究性学习小组对过量炭粉与氧化铁(Fe2O3)反应的气体产物成分进行研究。
(1)提出假设 ①气体产物是CO2。?②气体产物是CO。?③气体产物是__________。
(2)设计方案? 如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
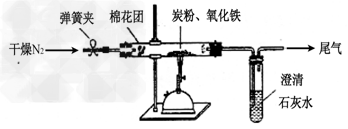
(3)查阅资料氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气,该反应的离子方程式:_______________。
(4)实验步骤
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g; ?
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。
步骤②、④中都分别通入N2,其作用分别为_____________。
(5)数据处理试根据实验数据分析判断,前面的假设_________(填①、②、③)是正确的。写出该实验中氧化铁与碳发生反应的化学方程式:______________________。
参考答案:(1)CO2、CO的混合物?
(3)NH4++NO2- N2↑+2H2O N2↑+2H2O
(4)步骤②中是为了排尽空气、步骤④是为了赶出所有的CO2,确保完全吸收 ?
(5)③;2C+Fe2O3 2Fe+CO↑+CO2↑ 2Fe+CO↑+CO2↑
本题解析:
本题难度:一般
3、填空题 (16分)某校化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题。
I、探究浓硫酸的某些性质
(1)按图示的连接装置,检查装置的气密性,称量E的质量。
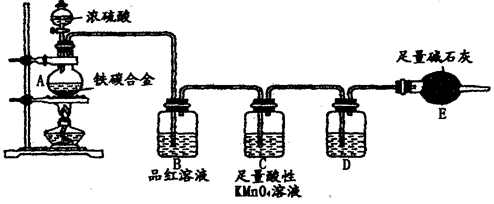
(2)将m g铁碳合金样品放入A中,再加入适量的浓硫酸。未点燃酒精灯前,A、B容器中均无明显现象,其原因是:___________________________________。
(3)点燃酒精灯一段时间后,A、B中可观察到明显的现象。
写出A中发生反应的化学方程式________________、____________________。
(4)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_________________________________________________。
Ⅱ、测定铁的质量分数
(5)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。则铁碳合金中铁的质量分数为_________________________(用含m、b的表达式表示)。
(6)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是空气中CO2、H2O进入E管使b增大。你认为改进的方法是_________________。
(7)乙同学认为,即使甲同学认为的偏差得到改进,依据此实
验测得合金中铁的质量分数也可能会偏高。你认为其中的原因
是__________________。
(8)某同学认为上述方法较复杂,使用下图所示的装置和其他
常用实验仪器测定某些数据即可。为了快速准确的计算出铁的
质量分数,最简便的实验操作是_____________(填写代号)。
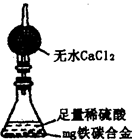
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、干燥、称量残渣的质量
C.测定反应前后装置和药品的总质量
参考答案:

本题解析:略
本题难度:简单
4、实验题 镍电池由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境 有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:

已知:
①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:

回答下列问题:
(1)根据上表数据判断步骤②依次析出沉淀Ⅱ:____和沉淀Ⅱ:____(填化 学式),则pH1____pH2(填“>”、“=”或“<”)。
(2)已知溶解度:NiC2O4>NiC2O4·H2O> NiC2O4·2H2O,则步骤③中反应的化学方程式是_______。第③步反应后,过滤沉淀I所需的玻璃仪器有___。
(3)步骤④中阳极反应产生的气体E为一黄绿色气体,写出步骤⑥中反应的离子方程式___
(4) FeCl3和AlCl3的混合溶液中加入NaOH溶液,若Fe(OH)3和Al(OH)3同时存在,则 c(Fe3+)/c(Al3+)=____。
参考答案:(1)Fe(OH)3 ;Al(OH)3 ;<
(2) NiCl2 +Na2C2O4+2H2O=NiC2O4·2H2O↓+2NaCl ;烧杯、漏斗、玻璃棒
(3)2Ni(OH)2 +2OH-+Cl2= 2Ni(OH)3 +2Cl-
(4)2×10-5
本题解析:
本题难度:一般
5、简答题 沈阳理工大学在废旧电池回收处理现状研究报告中报道了一种湿法处理方法,以下是对废旧电池材料(含有Ni(OH)2、碳粉、氧化铁和铝箔等)进行资源回收所设计的实验流程
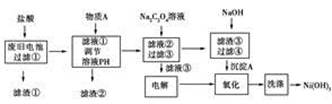
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③金属离子在该实验流程下完全沉淀的pH:
离子
| Al3+
| Fe3+
| Ni2+
| pH
| 5.2
| 4.1
| 9.7
|
回答下列问题:
(1)物质A 的作用是调节溶液的pH以除去杂质Fe3+和Al3+,以下最适合作为A物质的是________。
A.NiO? B.盐酸? C.NaOH? D.氨水
(2)滤渣②的主要成分是_________________________________。
(3)写出加入Na2C2O4溶液反应的化学方程式: _____________。
(4)写出电解滤液③的阴极反应式___________________________。
检验电解滤液③时阳极产生的气体的方法是用湿润的________试纸检验。
(5)由沉淀A生成Ni(OH)3的过程是先在滤渣③中加入过量NaOH溶液进行沉淀转化,待反应完全后再通入电解滤液③产生的气体进行氧化,请写出该氧化过程的离子方程式:__________________。
(6)如何检验Ni(OH)3是否洗涤干净?
________________________________。
参考答案:(1)A
(2)Fe(OH)3 Al(OH)3
(3)NiCl2+Na2C2O4+2H2O===NiC2O4·2H2O +2NaCl
(4)2H++2e-=== H2↑ 淀粉碘化钾?
(5)2Ni(OH)2+2OH -+ Cl2===2Ni(OH)3+2Cl-
(6)用试管取少量最后一次洗涤液,滴加硝酸银溶液,若没有白色沉淀生成,则说明Ni(OH)3已经洗涤干净,若有白色沉淀生成,则说明Ni(OH)3没有洗涤干净。
本题解析:滤液①中的溶质是NiCl2、HCl、AlCl3、FeCl3,用NiO调节溶液的pH既可以除去杂质Fe3+和Al3+,杂质Fe3+和Al3+分别转化为Fe(OH)3和Al(OH)3,又不引入其他杂质离子。则滤液②溶质主要是NiCl2,加入Na2C2O4后生成溶解度最小的NiC2O4·2H2O,故滤液③中主要含有NaCl,滤渣③中主要含有 NiC2O4·2H2O,NiC2O4·2H2O与NaOH溶液反应转化为Ni(OH)2,Ni(OH)2被电解滤液③时阳极产生的Cl2氧化为Ni(OH)3。
本题难度:一般
|