| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《盐类水解的原理》高频考点巩固(2017年模拟版)(四)
参考答案:B 本题解析:解:A.向Na2CO3溶液中滴加酚酞试液变红色,说明溶液呈碱性,原因是Na2CO3为强碱弱酸盐,水解呈碱性,与盐类水解有关,错误; B.铁在潮湿的环境下生锈为钢铁的电化学腐蚀,与盐类水解无关,正确;C.溶液颜色变深是因为加热促进盐类水解,错误;D.铁锈的成分是氧化铁,可以和酸发生反应,NH4Cl溶液中的弱离子水解导致溶液显示酸性,可作焊接金属中的除锈剂,与盐类水解有关,错误. 本题难度:一般 2、填空题 (10分)神舟十号飞船是中国“神舟”号系列飞船之一,它是中国第五艘搭载太空人的飞船。神舟十号飞船发射成功后,将与2011年发射升空的天宫一号目标飞行器进行交会对接,开展相关空间科学试验。火箭推进器是成功发射的重要因素,事实上,推进器的发展经历了一个漫长的过程。 参考答案:(每空2分,共10分)(1)① 本题解析:(1)①K2S是离子化合物,其电子式为 本题难度:困难 3、选择题 相同状况下,等体积的下列溶液,阴离子的总浓度最大的是 参考答案:A 本题解析: 本题难度:一般 4、填空题 (14分)(Ⅰ)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)-反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。 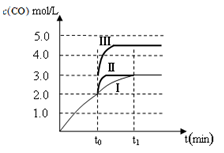 (3)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为 。 (Ⅱ)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。 (1)常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ; (2)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解配成250 mL 溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。第一份溶液中加入2滴酚酞试液,滴加0.25mol·L-1 NaOH 溶液至20mL时,溶液由无色变为浅红色。第二份溶液滴加0.10 mol·L-1 酸性KMnO4溶液至16mL时反应完全。则原试样中H2C2O4·2H2O的的质量分数为_______。 参考答案:(Ⅰ)(1)K1·K2(2分); >(2分) 本题解析:(Ⅰ)(1)反应①的平衡常数表达式K1=[CH3OH]/[CO][H2]2,反应②的平衡常数表达式K2="[CO]" [H2O]/[CO2][H2],反应③的平衡常数表达式K3=[CH3OH] [H2O]/[CO2][H2]3,则K3= K1·K2。500℃时反应③的平衡常数K3= K1·K2=2.5,在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15, Q=(0.3×0.15)÷(0.8×0.1)=0.5625,Q<K,反应正向进行,则此时V正>V逆。(2)对于反应②:在t0时刻改变一个条件,曲线Ⅰ变为曲线Ⅱ,由图像可知平衡时c(CO)不变,说明平衡没有移动,但缩短了达平衡的时间,改变的条件为加入催化剂;当曲线Ⅰ变为曲线Ⅲ时,CO的平衡浓度由3.0mol/L迅速变为4.5 mol/L,反应在3 L容积可变的密闭容器中发生,且该反应两边气体物质的系数相等,则改变的条件为将容器的体积(快速)压缩至2L。(3)醋酸的电离方程式为CH3COOH 本题难度:困难 5、选择题 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图,下列判断正确的是( ) | |||||||||||||||||||
参考答案:D
本题解析:pH=4的HCl溶液和NH4Cl溶液,在稀释过程中,因平衡NH4++H2O NH3·H2O+H+,正向移动,所以氯化铵溶液pH变化程度比盐酸pH变化程度小,故下方曲线为NH4Cl溶液。从图可知,a点溶液离子浓度大于c点,故导电能力a>c,A项错误;根据质子守恒,b点时溶液关系为c(H+)=c(NH3·H2O)+c(OH-),B项错误;b点为NH4+水解导致溶液呈酸性,b点溶液中NH4+和H+均消耗NaOH,故Vb>Vc,C项错误;NH4Cl溶液中NH4+水解,促进水的电离,a点溶液的pH小于b点,故溶液中水电离的H+浓度a点大于b点,c点是盐酸,抑制水的电离,故水的电离程度a>b>c,D项正确。
NH3·H2O+H+,正向移动,所以氯化铵溶液pH变化程度比盐酸pH变化程度小,故下方曲线为NH4Cl溶液。从图可知,a点溶液离子浓度大于c点,故导电能力a>c,A项错误;根据质子守恒,b点时溶液关系为c(H+)=c(NH3·H2O)+c(OH-),B项错误;b点为NH4+水解导致溶液呈酸性,b点溶液中NH4+和H+均消耗NaOH,故Vb>Vc,C项错误;NH4Cl溶液中NH4+水解,促进水的电离,a点溶液的pH小于b点,故溶液中水电离的H+浓度a点大于b点,c点是盐酸,抑制水的电离,故水的电离程度a>b>c,D项正确。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《氯及其化合.. | |