|
|
|
高考化学知识点归纳《离子方程式的书写及正误判断》在线测试(2017年最新版)(三)
2017-07-27 10:18:57
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列解释实验事实的方程式正确的是
A.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2 + CO2 ==CaCO3↓+H2O
B.漂白粉溶液在空气中失效:ClO- +CO2 +H2O ="==" HClO + HCO3-
C.将氯气溶于水制备次氯酸:Cl2 +H2O ===2H+ + Cl- + ClO-
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3- +Ca2+ +OH- ="==" CaCO3↓+ H2O
|
2、填空题 某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。
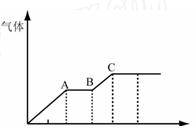
(1)写出下列各反应阶段所发生的离子反应式:
①写出O-A段发生的离子反应式: 。
②A-B段发生的离 子反应式: 。 子反应式: 。
③B-C段发生的离子反应式: 。
(2)分析A点溶液中主要存在那些离子: 。
(3)求原溶液中硫酸浓度是: 和硝酸的浓度是: 。
3、选择题 下列解释事实的离子方程式正确的是
A.铁和稀硝酸反应制得浅绿色溶液:Fe+ 4H+ + NO3- =Fe3+ + NO↑+ 2H2O
B.向Ca(ClO)2溶液中通入过量CO2制取次氯酸:2ClO-+ H2O + CO2=2HClO + CO32-
C.向酸性KMnO4溶液中通入SO2:2MnO4-+ 5SO2 + 4OH-=2Mn2++ 5SO42-+ 2H2O
D.0.01 mol·L—1 NH4Al(SO4)2溶液与0.02 mol·L—1 Ba(OH)2溶液等体积混合:NH4++ Al3++ 2SO42-+ 2Ba2++ 4OH—=2BaSO4↓+ Al(OH)3↓+ NH3·H2O
|
4、选择题 下列反应的离子方程式书写正确的是
A.NaHS水解:HS-+ H2O = S2-+ H3O+
B.向氯化铁溶液中加入铁:Fe3+ + Fe = 2Fe2+
C.氯化铝溶液加入过量的氨水:Al3+ + 4NH3?H2O = AlO2-+ 4NH4+ + 2H2O
D.硫酸铜水解:Cu2+ + 2H2O Cu(OH)2 + 2H+
Cu(OH)2 + 2H+
5、填空题 (10分)以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如下图所示。请回答下列问题:
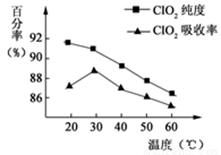
(1)由图可知,反应时需要控制的适宜温度是 ℃。
(2)黄铁矿中的硫元素在酸性条件下被ClO3—氧化成SO42—,写出制备二氧化氯的离子方程式 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得500mLClO2溶液,取出25.00mL,加入42.00mL0.500mol·L—1(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500mol·L—1K2Cr2O7标准溶液滴定至终点,消耗20.00mL。反应原理如下:
4H++ClO2+5Fe2+==Cl—+5Fe3++2H2O
14H++Cr2O72—+6Fe2+ ==2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(请写出计算过程)。
 Cu(OH)2 + 2H+
Cu(OH)2 + 2H+