微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分) 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
参考答案:
本题解析:
本题难度:困难
2、选择题 已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g) △H= +255.6kJ·mol-1
b.CH3CH2OH(g)+1/2O2(g)==3H2(g)+2CO(g) △H= +13.8kJ·mol-1
则下列说法不正确的是
[? ]
A.降低温度,可提高b路线中乙醇的转化率
B.从能量消耗的角度来看,b路线制氢更加有利
C.乙醇可通过淀粉等生物原料发酵制得,属于可再生资源
D.由a、b知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
参考答案:A
本题解析:
本题难度:一般
3、填空题 (4分)工业上常用天然气作为制备甲醇 的原料。已知:
的原料。已知:
①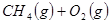

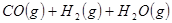
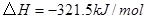
②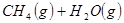

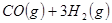
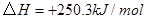
③


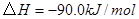
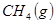 与
与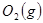 反应生成
反应生成 的热化学方程式为 。
的热化学方程式为 。
(2)向VL恒容密闭容器中充入 与
与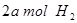 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示:
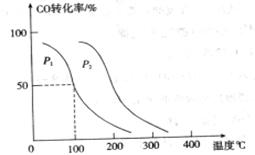
①压强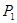
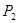 (填“<”、“>”或“=”)
(填“<”、“>”或“=”)
②在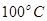 、
、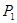 压强时,平衡常数为 (用含
压强时,平衡常数为 (用含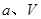 的代数式表示)。
的代数式表示)。
参考答案:(1)2CH4(g)+O2(g)=2CH3OH (g) ΔH=-251.2KJ/mol(2)① < ; ②V2/a2;
本题解析:(1)①+②+③×2整理可得2CH4(g)+O2(g)=2CH3OH (g) ΔH=-251.2KJ/mol。(2)① 作一条等温线,通过P1、P2,可见在相同的温度下,压强是P2时CO 的平衡转化率高,由于该反应的正反应是气体体积减小的反应,根据压强对平衡移动的影响,增大压强,平衡正向移动,物质的转化率提高,所以压强P1< P2. ②在100℃、P1压强时,由于CO的转化率是50%,则平衡时CO的物质的量浓度是0.5a/Vmol/L; H2的物质的量浓度是a/Vmol/L; CH3OH的物质的量浓度是0.5a/Vmol/L;所以平衡常数为0.5a/V÷[0.5a/V×(a/V)2]= V2/a2。
考点:考查盖斯定律的应用、热化学方程式的书写、压强对化学平衡移动的影响、化学平衡常数的计算。
本题难度:困难
4、选择题 白磷与氧气可发生如下反应:P4+5O2
参考答案:
本题解析:
本题难度:一般
5、简答题 (1)请用热化学方程式表示:
A.1mol?N2(g)与适量H2(g)起反应,生成2mol?NH3(g),放出92.2kJ热量______.
B.1mol?N2(g)与适量O2(g)起反应,生成2mol?NO2(g),吸收68kJ热量______.
(2)随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
B、CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol
由上述方程式可知,CH3OH的燃烧热______(填“大于”、“等于”或“小于”)192.9kJ/mol.已知水的气化热为44kJ/mol,则氢气燃烧热的热化学方程式为______.
参考答案:(1)A.1mol?N2(g)与适量H2(g)起反应,生成2mol?NH3(g),放出92.2kJ热量的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol;
B.1mol?N2(g)与适量O2(g)起反应,生成2mol?NO2(g),吸收68kJ热量的热化学方程式为N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol,故答案为:N2(g)+2O2(g)=2NO2(g)△H=+68kJ/mol;
(2)因燃烧热在某一温度和压强下lmol某物质B完全燃烧生成稳定化合物时所释放出的热量,而H2O的稳定化合物是液态水,H2O蒸汽转变为液态水需要放热,所以CH3OH的燃烧热大于192.9kJ/mol;
? CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol?①
? CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)△H=-192.9kJ/mol? ②
?②-①得?3H2(g)+3/2O2(g)=3H2O(g)△H=-241.9kJ/mol?③
?H2O(l)=H2O(g)△H=+44kJ/mol?④
③-④×3 得?3H2(g)+3/2O2(g)=3H2O(g)△H=-373.9kJ/mol?即H2(g)+1/2O2(g)=H2O(l)△H=-124.6kJ/mol,
故答案为:大于;H2(g)+1/2O2(g)=H2O(l)△H=-124.6kJ/mol.
本题解析:
本题难度:一般