微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
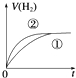
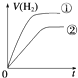
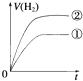
1、选择题 相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )
A.
B.
C.
D.
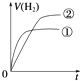
参考答案:C
本题解析:
本题难度:一般
2、选择题 已知25℃时有关弱酸的电离平衡常数.下列选项错误的是
| 弱酸 | HCOOH | HCN | H2CO3
电离平衡常数
1.77×10-5
4.9×10-10
Ki1=4.3×10-7Ki2=5.6×10-11
|
( )
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(NaHCO3)>pH(HCOONa)
B.2CN-+H2O+CO2→HCN+CO32-
C.等物质的量浓度的HCN溶液与NaOH溶液等体积混合后溶液中:c(OH-)>c(H+),c(Na+)>c(CN-)
D.NaHCO3和Na2CO3混合液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
参考答案:A、由电离常数Ka的关系可知,1.77×10-5>4.3×10-7>4.9×10-10>5.6×10-11,则酸性HCOOH>H2CO3>HCN>HCO3-,显然等浓度时Na2CO3的水解程度最大,其溶液的pH最大,则等物质的量浓度的各溶液pH关系为pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(HCOONa),故A错误;
B、氢氰酸的酸性大于碳酸氢根离子而小于碳酸,所以发生CN-+H2O+CO2→HCN+HCO3-反应,故B错误;
C、等物质的量浓度的HCN溶液与NaOH溶液等体积混合后反应生成NaCN,CN-水解溶液显碱性,所以c(OH-)>c(H+),c(Na+)>c(CN-),故C正确;
D、因溶液不显电性,则所有阳离子带的电荷总数等于阴离子带的负电荷总数,即c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正确;
故选AB.
本题解析:
本题难度:一般
3、选择题 下列事实不能说明醋酸是弱电解质的是( )
A.0.1 mol·L-1醋酸的pH比0.1 mol·L-1盐酸的pH大
B.醋酸能和碳酸钙反应放出CO2
C.0.1 mol·L-1醋酸钠溶液的pH=8.9
D.大小相同的锌粒分别与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
参考答案:B
本题解析:醋酸能和碳酸钙反应放出CO2只能说明醋酸的酸性比碳酸的酸性强,不能说明CH3COOH是弱电解质
本题难度:一般
4、填空题 在一定温度下,有a.盐酸,b.硫酸,c.醋酸三种酸(请用a、b、c序号填空)。
(1)当其物质的量浓度相同时,c(H+)由大到小的顺序是__________________。
(2)同体积、同物质的量浓度的三种酸,中和KOH的能力由大到小的顺序是__________。
(3)当三者pH相同时,其物质的量浓度由大到小的顺序为______________。
(4)同体积、同pH的三种酸,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是
____________。
(5)将pH相同的三种酸均加水稀释至原来的100倍后,pH由大到小的顺序__________。
参考答案:(1)b>a>c
(2)b>a=c
(3)c>a>b
(4)c>a=b
(5)a=b>c
本题解析:
本题难度:一般
5、选择题 在相同温度下,100mL?0.01mol/L醋酸与10mL?0.1mol/L醋酸相比,下列数值前者大于后者的是( )
A.中和时所需NaOH的量
B.电离程度
C.H+浓度
D.醋酸的物质的量
参考答案:B
本题解析:
本题难度:一般