微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题
高锰酸钾是锰的重要化合物和常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。请回答下列问题:
(1)通常高锰酸钾保存在棕色试剂瓶中,下列试剂不需要用棕色试剂瓶保存的是___(填字母代号)。
?a. 浓硝酸 b. 氯水 c. 烧碱
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质不同的是_______(填字母代号)。
a. 84消毒液(主要成分是NaClO) b. 75%酒精 c. 臭氧 d. 双氧水
(3)写出MnO2催化H2O2溶液制氧气的化学方程式______________。
(4)在用软锰矿制备高锰酸钾的生产中需要纯净的CO2气体。
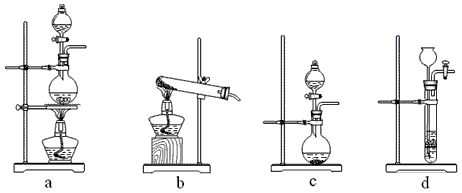
① 若实验室要制备纯净的CO2,从下列给出的试剂中最好选择_______(填字母代号)。
a. 石灰石 b. 浓盐酸 c. 稀硫酸 d. 纯碱
② 与上述所选试剂对应的气体发生装置是_______(填字母代号)。
(5)①通常状况下,酸性高锰酸钾溶液不能与下列物质中的_______反应(填字母代号)。
a. 乙醇 b. Na2SO3溶液 c. 环己烯 d. 苯 e. FeSO4溶液
②将用稀硫酸酸化的高锰酸钾溶液滴入盛有足量草酸溶液的试管中,振荡后,观察到的现象是______________。已知1mol草酸参加反应时转移的电子数是2×6.02×1023,锰元素在生成物中的化合价为+2。请写出此反应的化学方程式_____________________。
参考答案:(1)c
(2)b
(3)2H2O2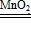 2H2O+O2↑
2H2O+O2↑
(4)①cd;②c
(5)①d;②高锰酸钾溶液的紫色褪去;2KMnO4+5H2C2O4+3H2SO4==2MnSO4+K2SO4+10CO2↑+8H2O
本题解析:
本题难度:困难
2、选择题 在KI和KIO3混合溶液中通入H2S发生反应后,只生成碘、硫酸钾和水,在此反应中被氧化的碘元素与被还原的碘元素的物质的量之比为(? )
A.5:1
B.6:1
C.1:1
D.1:5
参考答案:D
本题解析:因为生成碘单质,化合价为0价,KIO3碘元素由+5价到0价,降低5价,被还原,KI中碘元素由-1价升高到0价,被氧化,根据得失电子数相等,KIO3与KI的物质的量比为1:5,那么,被氧化的碘元素与被还原的碘元素的物质的量之比为1:5,选D。
本题难度:一般
3、选择题 水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+a OH-=Y+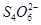 +2H2O下列说法中,不正确的是?(?)
+2H2O下列说法中,不正确的是?(?)
A.S2O32-是还原剂
B.Y的化学式为Fe2O3
C.a=4
D.每有1mol O2参加反应,转移的电于总数为4 mol
参考答案:B
本题解析:根据题意可知:Fe2+和S2O32-作还原剂失去电子。氧气得到电子作氧化剂。每有1mol O2参加反应,转移的电于总数为4 mol结合原子守恒可得Y的化学式为Fe3O4,a=4.选项为 :B。
本题难度:一般
4、填空题 雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为?。
(2)上述反应中的氧化剂是?,反应产生的气体可用?吸收。
(3)As2S3和HNO3有如下反应:
As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O若生成2 mol H3 AsO4,则反应中转移电子的物质的量为?。若将该反应设计成一原电池,则NO2应该在?(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2和11.2 L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量?(选填编号)。
a.小于0.5 mol?b.等于0.5 mol
c.大于0.5 mol?d.无法确定
参考答案:(1)1∶1
(2)As2S3?氢氧化钠溶液(或硫酸铜溶液)
(3)10 mol 正极
(4)a
本题解析:(1)As在As2S3中的化合价为+3,在As4S4中的化合价为+2,每摩As2S3转化为As4S4时得到2 mol e-,而每摩SnCl2转化为SnCl4时失去2 mol e-,故二者在反应时物质的量之比为1∶1。(2)H2S既可与NaOH溶液反应,又能与CuSO4溶液反应。(3)当生成2 mol H3AsO4时,同时生成了3 mol S,二者共失去电子10 mol。HNO3在反应中作氧化剂,在正极上发生反应,所以NO2应在正极上生成。(4)根据反应4NO2+O2+2H2O=4HNO3可知,反应共生成2 mol HNO3,浓HNO3与碳反应时的物质的量之比为4∶1,所以2 mol HNO3如完全反应可生成CO2 0.5 mol。但由于硝酸的浓度降低到一定程度时,碳就不再与硝酸反应,所以实际产生CO2的物质的量应小于0.5 mol。
本题难度:一般
5、填空题 化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
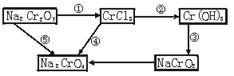
(1)在上述有编号的步骤中,需用还原剂的是___________,需用氧化剂的是___________ (填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是___________(填化学式)。
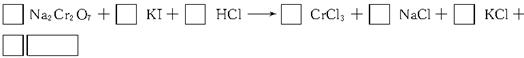
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
参考答案:(1)①?④
(2)Cr(OH)3
(3)1? 6? 14? 2? 2? 6? 3 ?7? H2O
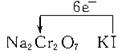
本题解析:(1)在①变化中,Cr元素由+7价变为+3价,化合价降低,需还原剂;②③两步变化中Cr元素的价态都是+3价,⑤步变化中Cr元素的价态都是+7价,②③⑤都是非氧化还原反应;在④步变化中,Cr元素由+3价变为+7价,化合价升高,需要氧化剂。
(2)Cr(OH)3既能与盐酸反应生成CrCl3,又能与NaOH反应生成NaCrO2,为两性氢氧化物。
(3)此小题考查了化学方程式的配平方法。先找出该反应的氧化剂、还原剂及氧化产物、还原产物,并配出其化学计量数;再由原子守恒配出NaCl、KCl的计量数,最后补充H2O,并配平其计量数。
本题难度:简单