微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 a mol FeS与b mol FeO投入到V L、c mol·L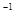 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63 g?②(a+b)×189 g
③(a+b) mol?④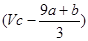 mol
mol
A.①④
B.②③
C.①③
D.②④
参考答案:D
本题解析:FeS和FeO在反应中共失去电子的物质的量是(a+8a+b)mol,所以被还原硝酸的物质的量是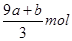 ,则没有被还原的硝酸的物质的量是
,则没有被还原的硝酸的物质的量是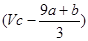 mol;根据铁原子守恒可知,没有被还原的硝酸是(3a+3b)mol,其质量是(a+b)×189 g,答案选D。
mol;根据铁原子守恒可知,没有被还原的硝酸是(3a+3b)mol,其质量是(a+b)×189 g,答案选D。
点评:该题是高考中的常见题型,属于中等难度的是,试题基础性强,侧重学生能力的考查。化学计算中的守恒法主要是指质量守恒定律、电子的得失守恒、原子守恒和电荷守恒等,需要学生在平时的训练中注意总结和积累。
本题难度:一般
2、填空题 铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s) + 3O2 (g) = 2Cu2O(s) + 2SO2(g)?△H=-768.2kJ·mol-1,①
2Cu2O(s) + Cu2S(s) =" 6Cu(s)" + SO2(g)?△H=+116.0kJ·mol-1,②
①热化学方程式:Cu2S(s) + O2(g) =" 2Cu(s)" + SO2(g) △H= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备
4CuSO4 + 3H3PO2 + 6H2O =" 4CuH↓" + 4H2SO4 + 3H3PO4?。
①该反应还原剂是 (写化学式)。
②该反应每转移3 mol电子,生成CuH的物质的量为 。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图。

①当c(Cl-)="9" mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)="1" mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
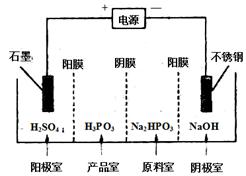
(4) 电解Na2HPO3溶液可得到亚磷酸,装置如图(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)
①阳极的电极反应式为____________________。
②产品室中反应的离子方程式为____________。
参考答案:(16分)(1)①Cu2S(s)+O2(g)=2Cu(s)+SO2(g)?△H=-217.4KJ/mol;(2分)
②阳;(2分)
(2)①H3PO2(2分);②1mol(2分);
(3)①c(CuCl2)>c(CuCl+)>c(CuCl3-)(2分);
②Cu2++Cl-═CuCl+(2分).
(4)①4OH--4e-=2H2O+O2↑(2分)
②HPO32-+2H+=H3PO3(2分)
本题解析:(1)①根据盖斯定律可得Cu2S(s) + O2(g) =" 2Cu(s)" + SO2(g) △H=(①+②)/3=(-768.2kJ·mol-1+116.0kJ·mol-1)/3=-217.4KJ/mol;
②粗铜精炼时,粗铜作阳极,纯铜作阴极;
(2)①根据还原剂的判断,元素化合价升高的物质作还原剂,在4CuSO4 + 3H3PO2 + 6H2O =" 4CuH↓" + 4H2SO4 + 3H3PO4?中P元素的化合价升高,所以还原剂是H3PO2;
②该反应中每生成4molCuH转移 12mol电子,所以每转移3 mol电子,生成CuH的物质的量为1mol;
(3)①由图可知,当c(Cl-)="9" mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为c(CuCl2)>c(CuCl+)>c(CuCl3-);
②从图上可见,在c(Cl-)=1mol?L-1的氯化铜溶液中,主要是Cu2+与Cl-结合生成CuCl+,方程式为:Cu2++Cl-═CuCl+;
(4)①根据离子的放电顺序及溶液中离子的种类,在阳极放电的是氢氧根离子,所以阳极电极反应式为4OH--4e-=2H2O+O2↑;
②产品室中有亚磷酸生成,原料室中的磷酸氢根离子通过阴膜到达产品室,与通过阳膜到达产品室的氢离子结合生成亚磷酸,所以产品室中的离子方程式为HPO32-+2H+=H3PO3。
本题难度:一般
3、选择题 向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A.Cu与Cu2O 的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
参考答案:B
本题解析:发生的反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑,+4H2O;3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O,39.2g沉淀为Cu(OH)2设Cu的物质的量为xmol,Cu2O的物质的量为ymol,依题意可列方程式64x+144y=27.2;(x+2y)×98=39.2解得x=0.2moly=0.1molA、x:y=0.2:0.1=2:1,正确;B、由方程式可知NO的物质的量0.2mol,所以HNO3的物质的量为1.2mol,其物质的量浓度为1.2mol·L-1,错误;C、由方程式可知NO的物质的量0.2mol,其体积为4.48L,正确。D、由方程式可知反应的硝酸的总量为1mol,故剩余的硝酸的量为0.2mol,故选B。
本题难度:一般
4、填空题 (6分)有人在研究硫酸亚铁受热分解反应时,作了两种假设:
⑴假设它按氯酸钾受热分解的方式来分解,反应的化学方程式为:?
⑵假设它按碳酸钙受热分解的方式来分解,反应的化学方程式为:?
⑶事实上,硫酸亚铁分解为氧化铁,二氧化硫,三氧化硫(分解温度为500℃左右),则反应化学方程式为:??
参考答案:(6分,每空2分)
⑴FeSO4?△??FeS +2O2↑?⑵ FeSO4△??FeO +SO3↑?
⑶ 2FeSO4△??Fe2O3 +SO2↑+SO3
本题解析:略
本题难度:一般
5、填空题 研究物质间的氧化还原反应有重要的意义。
(1)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是___________;生成0.5molK2FeO4转移电子的物质的量____________mol。
(2)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O
3Zn+2K2FeO4+8H2O
放电时,电池的负极反应式为____________。充电时电解液的pH____________(填“增大”“不变”或“减小”)
(3)H2O2是一种绿色氧化剂。工业制备H2O2的原理如下:
①电解池总反应:2S2O42?+2H+═S2O82-+H2↑
②电解生成的S2O82-水解:S2O82-+2H2O═H2O2+2H++SO42?
电解池中阴极反应式____________。
参考答案:(1)KClO;1.5mol(2)Zn+2OH--2e-=Zn(OH)2;减小(3)2H++2e-=H2↑
本题解析:(1)该反应中,铁元素的化合价由+3价变为+6价,氯元素化合价由+1价变为-1价,所以氢氧化铁是还原剂,次氯酸钾是氧化剂,生成0.5mol K2FeO4转移的电子的物质的量=0.5mol×(6-3)=1.5mol,答案为:KClO,1.5;(2)该原电池放电时,负极上锌失电子和氢氧根离子反应生成氢氧化锌,电极反应式为:Zn+2OH--2e-=Zn(OH)2,充电时,氢氧根离子参加反应生成水,所以随着反应的进行,氢氧根离子浓度减小,溶液的pH减小,答案为:Zn+2OH--2e-=Zn(OH)2[或3Zn+6OH--6e-=3Zn(OH)2或Zn+2OH-=Zn(OH)2+2e-均合理],减小;(3)电解时阴极上得电子发生还原反应,根据电池反应式知,氢离子得电子发生还原反应,所以阴极上的电极反应式为:2H++2e-=H2↑,故答案为:2H++2e-=H2↑.
本题难度:一般