微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 以下是有关SO2、Cl2的性质实验。
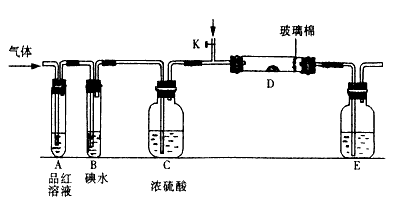
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。 若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?____________- (填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为_____________ 。
(2)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式________________ 。
(3)将0.23 mol SO2和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应,在一定温度下,反应达到平衡,得到0.12 mol SO3.则反应的平衡常数K=_____________ 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度_____________ 。(填“填大”、“不变”或“减小”),氧气的转化率 _____________(填“升高”、“不变”或“降低”)。
参考答案:(1) 相同;2SO2 + O2 2SO3?
2SO3?
(2) 4Cl2 + S2O32-+ 5H2O == 2SO42-+ 8Cl-+ 10H+
(3)K=23.8 mol/L?; 减小?; 降低
本题解析:
本题难度:一般
2、实验题 某校化学兴趣小组为研究Cu与不同浓度硫酸反应的情况并制备少量硫酸铜,进行如下实验。
探究1:铜与稀硫酸的反应

通过实验发现,铜不能与稀硫酸直接反应。为了制取少量硫酸铜晶体,该小组同学采用在实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶可制得硫酸铜晶体(装置如图1所示)请回答:
(1)把浓硝酸分多次加入到铜粉与稀硫酸的混合物中的目的是__________________。
(2)图1是一套改进装置,其优点除可以防止倒吸外,还有____________。
探究2:铜与浓硫酸的反应该小组同学在实验中发现使用教材所提供的实验装置进行铜和浓硫酸的反应不仅安全性差而且易造成环境污染等。经过讨论,该小组设计了如图2的装置并进行实验。
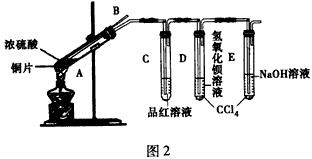
(3)请写出长导管B的作用___________(只写一点就可)。
(4)对试管A进行加热,发现E试管中有气泡逸出,品红溶液很快褪色,但最终未见D试管中氢氧化钡溶液出现浑浊。为探究D试管中未出现浑浊的原因,该小组同学在化学手册中只查阅到下列物质常温下的溶解度数据

请你应用类比研究的方法帮他们预测D试管未出现浑浊的原因:___________________。
(5)为验证D试管中溶液的组成,进行了下列实验,请你帮他们完成下列实验内容

参考答案:
(1)确保所有的硝酸都作氧化剂,在溶液中将铜氧化,以生成硫酸铜
(2)确保所有的氮氧化合物都被吸收掉
(3)防止C中的液体倒吸(或检验反应时导管是否堵塞或拆卸装置前从B管口向试管A中大量鼓气,以排尽A中的SO2气体,不会产生污染等,合理答案均可)
(4)生成了溶解度较大的Ba(HSO3)2
(5) (答案合理即可)
(答案合理即可)
本题解析:
本题难度:困难
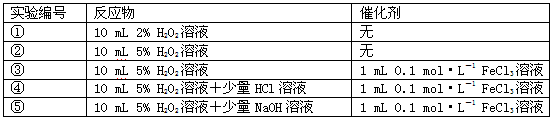
3、实验题 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
(1)催化剂能 加快化学反应速率的原因是__________________________________。
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为___________________。
(3)实验①和②的目的是___________________________________________________。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________________。
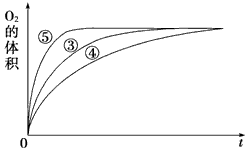
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。 分析上图能够得出的实验结论是_____________________________________________。
参考答案:(1)降低了反应所需的活化能
(2)H2O2 H++HO2-
H++HO2-
(3)探究浓度对反应速率的影响 ;向反应物中加入等量同种催化剂(或将盛有反应物的试管放入同一热水浴中)
(4)碱性环境能加快H2O2分解的速率,酸性环境能减慢H2O2分解的速率
本题解析:
本题难度:一般
4、选择题 不活泼金属不能与非氧化性酸发生自发的置换反应,但某学生喜欢探究欲完成
2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是?(?)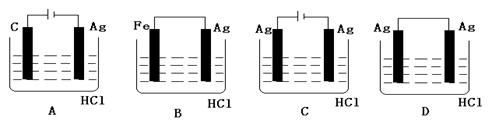
参考答案:C
本题解析:略
本题难度:一般
5、实验题
 3H2O+N2,而氮化镁遇水即反应生成Mg(OH)2和NH3,下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框图(实验前系统内的空气已排除,图中箭头表示气体的流向)。
3H2O+N2,而氮化镁遇水即反应生成Mg(OH)2和NH3,下面是甲、乙两位学生提出的制备氮化镁的两种实验方案示意框图(实验前系统内的空气已排除,图中箭头表示气体的流向)。
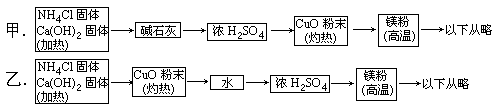
(1)甲、乙两生提出的实验方案是否能制得氮化镁?(填“能”或“不能”)甲______乙_____。
(2)具体说明不能制得氮化镁的原因(如果两个方案都能制得氮化镁,此小题不用回答)。
答:________________________________________。
参考答案:(1)甲不能,乙能(2)甲方案中反应产生的NH3全部被浓H2SO4吸收,不能进行后续反应
本题解析:甲方案制得的NH3经过碱石灰干燥,再经过浓H2SO4时和硫酸反应生成(NH4)2SO4,使得反应到此终结,后边反应由于没有NH3无法进行,因此不能得到氮化镁,在这里,甲方案可以立即予以否定,即使本方案第4步也不合理,但已无须考虑和提出了。乙方案改正了甲方案的两点错误,NH3被CuO氧化成N2后,经过水洗除去未反应的NH3,最后氮气经浓H2SO4干燥后与高温镁粉反应得氮化镁,该方案是可行的。
本题难度:一般