微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各项实验操作中,正确的是
A.检验溴乙烷中的溴元素时,将溴乙烷和氢氧化钠溶液混合加热后,需加硫酸酸化
B.为加快过滤速度,可用玻璃棒搅拌过滤器中的食盐水
C.为迅速除去乙酸乙酯中的少量乙酸,可加入足量NaOH溶液并加热
D.为使制取H2的速率加快,可向稀H2SO4中加少量CuSO4溶液
参考答案:D
本题解析:A 错误,加入硫酸酸化,再加硝酸银时会得到硫酸银白色沉淀,干扰溴离子的检验。
B 错误,不能用玻璃棒搅拌滤纸,会使滤纸破损,使过滤失败
C 错误,除去乙酸乙酯中的少量乙酸,不能加入NaOH溶液,因为酯在碱性溶液中水解
D 正确,制取H2时,可在稀H2SO4中加少量CuSO4溶液,锌和硫酸铜反应生成铜,铜和锌形成原电池,能加快制取H2的速率
本题难度:一般
2、简答题 如图是实验室制SO2并验证SO2某些性质的装置图.
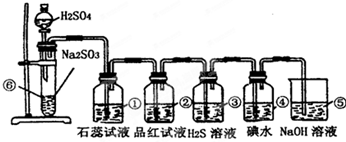
试回答:
(1)①中的实验现象是______,此实验证明SO2是______性气体.
(2)②中的品红溶液______,证明SO2有______性.
(3)③中的实验现象是______,证明SO2有______性.化学反应方程式______
(4)④中的实验现象是______,证明SO2有______性.化学反应方程式______
(5)⑤中的作用是______,反应的化学方程式是______.
参考答案:(1)①二氧化硫与水反应生成亚硫酸,遇石蕊变红,则实验现象变红,说明二氧化硫为酸性气体,故答案为:变红;酸;
(2)因二氧化硫具有漂白性,则②中的品红溶液褪色,故答案为:褪色;漂白;
(3)③中二氧化硫与硫化氢发生氧化还原反应生成单质S,该反应为SO2+2H2S═3S↓+2H2O,实验现象为淡黄色沉淀生成,二氧化硫中S元素的化合价降低,则二氧化硫具有氧化性,
故答案为:淡黄色沉淀生成;氧化;SO2+2H2S═3S↓+2H2O;
(4)④中二氧化硫与碘水发生氧化还原反应生成硫酸和HI酸,该反应为SO2+I2+2H2O═2HI+H2SO4,实验现象为碘水褪色,二氧化硫中S元素的化合价升高,说明二氧化硫具有还原性,
故答案为:碘水褪色;还原;SO2+I2+2H2O═2HI+H2SO4;
(5)⑤中的作用是吸收二氧化硫,防止二氧化硫污染环境,发生的化学反应为SO2+2NaOH═Na2SO3+H2O,故答案为:吸收二氧化硫,防止二氧化硫污染环境;SO2+2NaOH═Na2SO3+H2O.
本题解析:
本题难度:一般
3、实验题 已知非金属单质硫是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是?,烧瓶中加入的试剂是?。
(2)画出虚线框内的实验装置图,并注明所加试剂,说明装置的作用?。
(3)装置B中盛放的试剂是?(选填下列所给试剂的代码),实验现象为?,反应的化学方程式为?。
A.Na2S溶液? B.Na2SO3溶液? C.Na2SO4溶液?
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)?。
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,该反应的离子方程式为?。
参考答案:(1)浓盐酸?; MnO2;
(2) ?;除去Cl2中的HCl气体;
?;除去Cl2中的HCl气体;
(3)A ;有淡黄色沉淀生成 ; Na2S+Cl2 =2NaCl+ S↓ ;?
(4)HCl的稳定性比H2S的强,HClO4的酸性比H2SO4的强等
(5)Cl2 + 2OH— =Cl— + ClO—+ H2O
本题解析:(1)装置A用于Cl2的制取,把MnO2放在烧瓶中,把浓HCl放在分液漏斗中。(2)加热A装置,发生反应:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,由于HCl有挥发性,所以在洗气瓶中放入饱和NaCl溶液来除去Cl2中的杂质HCl。导气管的接法是长进短出。把经过除杂的氯气通入到饱和的Na2S溶液中,由于氧化性Cl2>S,所以会发生反应:Na2S+Cl2 =2NaCl+ S↓。由于S是淡黄色难溶于水的物质,因此会看到产生淡黄色沉淀。(4)证明元素的非金属性的强弱,除了活动性强的能把活动性弱的从化合物中置换出来外,还可以通过比较元素的氢化物的稳定性及相应的最高价氧化物对应的水化物的酸性强弱。即HCl的稳定性比H2S的强,HClO4的酸性比H2SO4的强等。(5)由于Cl2是有毒的气体,所以在排放到空气之前要用NaOH溶液对其进行尾气处理。该反应的离子方程式为Cl2 + 2OH— =Cl— + ClO—+ H2O。2的实验室制法、实验装置及试剂的选择、元素非金属性的比较、离子方程式的书写的知识。
MnCl2+Cl2↑+2H2O,由于HCl有挥发性,所以在洗气瓶中放入饱和NaCl溶液来除去Cl2中的杂质HCl。导气管的接法是长进短出。把经过除杂的氯气通入到饱和的Na2S溶液中,由于氧化性Cl2>S,所以会发生反应:Na2S+Cl2 =2NaCl+ S↓。由于S是淡黄色难溶于水的物质,因此会看到产生淡黄色沉淀。(4)证明元素的非金属性的强弱,除了活动性强的能把活动性弱的从化合物中置换出来外,还可以通过比较元素的氢化物的稳定性及相应的最高价氧化物对应的水化物的酸性强弱。即HCl的稳定性比H2S的强,HClO4的酸性比H2SO4的强等。(5)由于Cl2是有毒的气体,所以在排放到空气之前要用NaOH溶液对其进行尾气处理。该反应的离子方程式为Cl2 + 2OH— =Cl— + ClO—+ H2O。2的实验室制法、实验装置及试剂的选择、元素非金属性的比较、离子方程式的书写的知识。
本题难度:一般
4、选择题 下列实验方法使用不合理的是
A.用结晶法从水溶液中获得氯化铁晶体
B.用纸上层析法检验氯化铁溶液中是否混有少量氯化铜
C.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量必需相等
D.用AgNO3溶液、稀硝酸鉴别亚硝酸钠和食盐
参考答案:C
本题解析:
答案:C
A.正确,先向溶液中加适量盐酸,蒸发浓缩、冷却结晶,从水溶液中获得氯化铁晶体;
B.正确,溶质粒子在同一介质中运动的速率不同,用纸上层析法检验氯化铁溶液中是否混有少量氯化铜;
C.不合理,为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量必需有一种过量。
D.正确,用AgNO3溶液、稀硝酸鉴别亚硝酸钠和食盐,食盐形成AgCl沉淀。
本题难度:一般
5、实验题 四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃;金属锡的熔点为231℃,拟用以下仪器,设计组装一套实验装置,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)请回答下列各个问题。
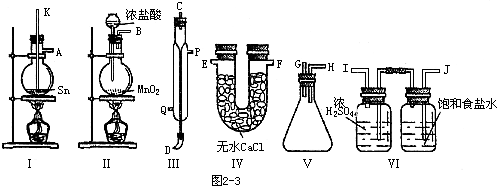
A.用玻璃管(未画出)连接上述装置,正确的顺序是(填各接口的代字母)
( )接( )、( )接( )、( )接( )、( )接( )、( )接( );
B.装置Ⅵ作用是______;装置Ⅳ的作用是______;
C.冷凝管里冷水的流向是从______进入,从________流出;
D.实验时应先点燃_______处酒精灯,加热温度应大于______℃,待_______即可停止加热;