| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《物质组成与性质实验方案的设计》高频考点特训(2017年练习版)(四)
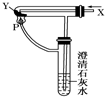 参考答案:A、氢气能燃烧,但是和氧化铁反应不会生成二氧化碳,不会看到澄清石灰水变浑浊,故A错误. 本题解析: 本题难度:一般 3、实验题 如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入Ba(OH)2溶液至恰好完全反应(设H2SO4和Ba(OH)2溶液密度相同)。试回答: 参考答案:(1) ①溶液里有白色沉淀产生; ②小球下沉到烧杯底; 本题解析: 本题难度:一般 4、实验题 实验室需要配制O.5 mol·L一的烧碱溶液450ml,根据溶液配制的过程,回答下列问题: 参考答案:(1)500 ml容量瓶、烧杯、胶头滴管(2)10.O?(3)C 本题解析:略 本题难度:简单 5、实验题 (10分)某教师在课堂上用如图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质 参考答案:(10分)(1)品红溶液褪色; 漂白[ 本题解析:略 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《化学键与物.. | |