| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《化学平衡》考点预测(2017年强化版)(八)
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是______________________。 参考答案:(12分) 本题解析:略 本题难度:简单 2、填空题 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)
A.  B. B. C.P1<P2D. C.P1<P2D.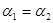 ②求 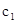 =___________、 =___________、 =___________、 =___________、 =___________。 =___________。参考答案:(共13分)(1)A? 2分?(2)0.0625? 2分 本题解析:(1)正方应是吸热反应,平衡时升高温度平衡向正反应方向移动,平衡常数K值增大,A正确;B、反应前后体积不变,则增大压强平衡不移动,而平衡常数只与温度有关系,则K值不变,B不正确;C、充入一定量CO,平衡向逆反应方向移动,但平衡常数不变,C不正确;D、降低温度平衡向逆反应方向移动,平衡常数减小,D不正确,答案选A。 本题难度:一般 3、选择题 在容积一定的密闭容器中,可逆反应A2(g)+B2(g)?xC(g).符合如图Ⅰ所示关系.由此推断,对图Ⅱ的正确说法是( ) 参考答案:D 本题解析: 本题难度:一般 4、选择题 下列说法正确的是 参考答案:B 本题解析:试题分析:碳的燃烧为放热反应,但是其不能自发进行,而某些分解反应在常温下却可以进行,故A错误; NH4HCO3(s)=====NH3(g)+H2O(g)+CO2(g)?△H="+185.57" kJ·mol-1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向,故C正确,为该题的答案;焓变或熵变均不可以单独作为反应自发性的判据,故C错误;在其他外界条件不变的情况下,使用催化剂,不可以改变化学反应进行的方向,故D错误。 本题难度:一般 5、选择题 T ℃时,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是 |
参考答案:C
本题解析:反应开始到10s时,Z的物质的量增加了1.60mol,X和Y的物质的量分别减少了1.20mol-0.40mol=0.8mol和1.00mol-0.20mol=0.8mol,所以方程式应该是X(g)+Y (g) 2Z(g)。10s时物质的浓度不再发生变化,反应达到平衡状态,此时X、Y的转化率不相同,A不正确;反应前后体积不变,改变压强平衡不移动,B不正确;平衡时正逆反应速率相等,但不为0,选项C正确;容器的容积是2L,所以该反应的平衡常数K=
2Z(g)。10s时物质的浓度不再发生变化,反应达到平衡状态,此时X、Y的转化率不相同,A不正确;反应前后体积不变,改变压强平衡不移动,B不正确;平衡时正逆反应速率相等,但不为0,选项C正确;容器的容积是2L,所以该反应的平衡常数K=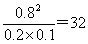 ,D不正确,答案选C。
,D不正确,答案选C。
考点:考查反应速率、转化率的计算以及外界条件对平衡状态的影响和方程式的判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重考查学生基础知识的同时,侧重考查学生灵活运用基础知识解决实际问题的能力。该题的关键是明确反应速率的含义以及表达式,然后结合图像和题意灵活运用即可,有利于培养学生的规范答题能力和逻辑推理能力。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《化学实验的.. | |