微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某恒温密闭容器中,可逆反应A(s)  B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B+C(g) ΔH=" +Q" kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗
2、选择题 在体积恒定的密闭容器中,1mol?A(g)与1mol?B(g)在催化剂作用下加热到500℃发生反应:A(g)+nB(g)
C(g)+D(g);△H>0达到平衡,下列判断正确的是( )
A.升高温度v正增大,v逆减小,平衡向正反应方向移动
B.平衡后再加入l?mol?B,上述反应的△H增大
C.当n<1时,通人惰性气体,压强增大,平衡向逆反应方向移动
D.若n=1且A的转化率为50%,则平衡常数等于1
3、填空题 一定温度下,向如图所示带有可移动活塞的密闭容器中充入2 L SO2和1 L O2的混合气体,发生如下反应2 SO2 (g) + O2 (g) 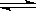 2 SO3 (g) 。
2 SO3 (g) 。
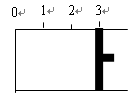
(1)若活塞可自由移动,平衡后,活塞停止在“2.1”处,则该反应中SO2的转化率为____?____。
(2)若开始时,充入容器的起始物质分别是
①2 L SO2和1 L O2;
②2 L SO3 (g) 和 1 L N2 ;
③1 L SO2、1 L O2和 1 L SO3 (g),
使活塞固定在“3”处,达到平衡后,容器中SO3 (g)占反应混合物的体积分数的大小关系是:
?(用序号和“<”、“=”、“>”表示)。
(3)向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量。
写出SO2发生氧化反应的热化学方程式:________?。
4、填空题 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),右下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),右下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
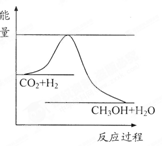
(1)关于该反应的下列说法中,正确的是 。
A.△H>0,△S>0; B.△H>0,△S<0;
C.△H<0,△S<0; D.△H<0,△S>0。
(2)该反应平衡常数K的表达式为 。
(3)温度降低,平衡常数K (填“增大”、“不变”或“减小”)。
(4)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时问变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)___: mol·L-1·min-1。
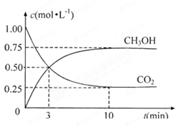
(5)下列措施中能使(4)中n(CH3OH)/n(CO2)增大的有 。
A.升高温度;
B.加入催化剂;
C.将H2O(g)从体系中分离;
D.再充入1molCO2和3molH2;
E.充入He(g),使体系总压强增大。
5、填空题 为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏,化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3)。 CCl4+H2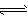 CHCl3 +HCl 此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)。
CHCl3 +HCl 此反应伴随有副反应,会生成CH2Cl2、CH3Cl和CH4等。已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃。在密闭容器中,该反应达到平衡后,测得如下数据(假设不考虑副反应)。

①此反应在110℃时平衡常数为____。
②实验1中,CCl4的转化率A____50%(填“大于”、“小于”或“等于”)。
③实验2中,10h后达到平衡,H2的平均反应速率为____。在此实验的平衡体系中,再加入0.5mol CCl4和1.0mol HCl,平衡将向___反应方向移动。
④实验3中,B的值___(选填序号)。
A.等于50%
B.大于50%
C.小于50%
D.从本题资料,无法判断