|
高考化学知识点总结《化学平衡》考点巩固(2017年最新版)(四)
2017-08-01 00:09:23
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有关化学化学平衡状态的特征,下列说法正确的是
A.所有的化学反应都存在化学平衡状态
B.平衡时反应已经达到最大限度,反应停止了
C.平衡时各组分的浓度相等
D.化学平衡状态是一种动态平衡
|
参考答案:D
本题解析:对于可逆反应来说,当反应进行到一定程度时,v(正)=v(逆)≠0,反应物和生成物的质量(或浓度)保持不变,该可逆反应达到了化学平衡状态,A.只有可逆反应才存在化学平衡状态,错误;B、平衡时反应已经达到最大限度,但并未停止,错误;C、平衡时各组分的浓度保存不变,但并不相等 ,错误;D、化学平衡状态是一种动态平衡,正确;选D。
考点:考查化学化学平衡状态的特征。
本题难度:一般
2、选择题 在容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g),有如图所示的关系曲线,根据下图下列判断正确的是( ? )
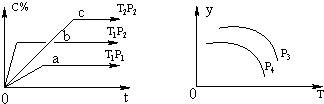
A.p3>p4,y轴表示A的转化率
B.p3<p4,y轴表示混合气体的密度
C.p3<p4,y轴表示B的质量分数
D.p3<p4,y轴表示混合气体的平均摩尔质量
参考答案:A
本题解析:
本题难度:简单
3、填空题 (14分)Ⅰ、已知:C(s)+H2O(g) CO(g)+H2(g); ΔH一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表: CO(g)+H2(g); ΔH一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h
| 0
| 1
| 2
| 4
| 8
| 16
| 20
| 25
| 30
| 总压强p/100 kPa
| 4.56
| 5.14
| 5.87
| 6.30
| 7.24
| 8.16
| 8.18
| 8.20
| 8.20
|
回答下列问题:
(1)下列哪些选项可以说明该可逆反应已达平衡状态 。
A.混合气体的密度不再发生改变
B.消耗1 mol H2O(g)的同时生成1 mol H2
C.混合气体的总体积
D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总= mol;
Ⅱ、根据最新“人工固氮”的报道,在常温、常压、光照条件下,N2在催化剂表面可与水发生反应生成NH3,反应方程式:2N2(g)+ 6H2O(l)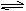 4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表: 4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表:

(1)该反应的△H_____O, △S____0(填“>,<,=”)
(2)该反应在30℃、40℃时化学平衡常数分别为K1、K2,则K1_______K2(选填“>,<,=”)
(3)与目前广泛应用的工业合氨相比,该方法的固氮速率慢,氨的生成浓度低,有人提出在常压、450℃下进行该反应,效率将更高,科学家认为该方案不可行,理由是__________.
Ⅲ、向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。
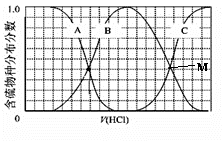
试分析:
①B曲线代表 (用微粒符号表示)分数变化;滴加过程中,溶液中一定成立:c(Na+)= 。
②M点,溶液中主要涉及的离子方程式: 。
参考答案:I、(1)AD ; (2)P/P0
II、(1)>, > (2)<
(3)在常压、450℃条件下,水处于气态,该反应的△H>0, △S<0,所以该反应不能自发进行
Ⅲ、(1)HS- ; c(Na+)=3[c(H2S)+c(HS-)+c(S2-)](由物料守恒得出)
或c(Na+)= c(Cl-)+c(OH-)+c(HS-)+2c(S2-)-c(H+)(由电荷守恒得出)
(2)M点:2S2-+3H+=HS-+H2S(分两步写也可)
本题解析:Ⅰ、(1)C(s)+H2O(g) CO(g)+H2(g)在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应过程中气体总质量不断增大,故密度不断增大,当混合气体密度不再发生改变,则反应达到平衡状态,A项正确;反应过程中消耗1 mol H2O(g)的同时生成1 mol H2,B项错误;恒容,故混和气体总体积不变,C项错误;v正(CO) = v逆(H2)则说明正逆反应速率相等,反应达到平衡状态,故D项正确;(2)同温、同体积压强之比等于物质的量之比,故n(总)= P/P0×1mol= P/P0mol;Ⅱ、(1)2N2(g)+ 6H2O(l) CO(g)+H2(g)在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应过程中气体总质量不断增大,故密度不断增大,当混合气体密度不再发生改变,则反应达到平衡状态,A项正确;反应过程中消耗1 mol H2O(g)的同时生成1 mol H2,B项错误;恒容,故混和气体总体积不变,C项错误;v正(CO) = v逆(H2)则说明正逆反应速率相等,反应达到平衡状态,故D项正确;(2)同温、同体积压强之比等于物质的量之比,故n(总)= P/P0×1mol= P/P0mol;Ⅱ、(1)2N2(g)+ 6H2O(l) 4NH3(g)+ 3O2(g),反应,由表中所给NH3的平衡浓度与温度关系可知升高温度NH3的平衡浓度增大,故平衡正向移动,则该反应吸热,△H>0;该反应正向气体量增多,故△S>0;(2)该反应在30℃、40℃时化学平衡常数分别为K1、K2,则K1< K2;(3)在常压、450℃条件下,水处于气态,该反应的△H>0, △S<0,所以该反应不能自发进行,故该反应不可采用常压、450℃;Ⅲ、向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量,发生反应为:①H++ OH—=H2O、②S—+ H+=HS-、③HS-+ H+= H2S,故曲线B代表HS-变化;滴加过程中物料守恒:2c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],或电荷守恒:c(Na+)+ c(H+)= c(Cl-)+c(OH-)+c(HS-)+2c(S2-);M点溶液溶质为:NaCl、NaHS、H2S,故溶液中主要涉及的离子方程式S—+ H+=HS-、HS-+ H+= H2S(或2S2-+3H+=HS-+H2S)。 4NH3(g)+ 3O2(g),反应,由表中所给NH3的平衡浓度与温度关系可知升高温度NH3的平衡浓度增大,故平衡正向移动,则该反应吸热,△H>0;该反应正向气体量增多,故△S>0;(2)该反应在30℃、40℃时化学平衡常数分别为K1、K2,则K1< K2;(3)在常压、450℃条件下,水处于气态,该反应的△H>0, △S<0,所以该反应不能自发进行,故该反应不可采用常压、450℃;Ⅲ、向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量,发生反应为:①H++ OH—=H2O、②S—+ H+=HS-、③HS-+ H+= H2S,故曲线B代表HS-变化;滴加过程中物料守恒:2c(Na+)=3[c(H2S)+c(HS-)+c(S2-)],或电荷守恒:c(Na+)+ c(H+)= c(Cl-)+c(OH-)+c(HS-)+2c(S2-);M点溶液溶质为:NaCl、NaHS、H2S,故溶液中主要涉及的离子方程式S—+ H+=HS-、HS-+ H+= H2S(或2S2-+3H+=HS-+H2S)。
考点:化学反应原理及图像问题。
本题难度:困难
4、选择题 在恒温时,一固定容积的容器内发生如下反应:2NO2(g)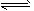 N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数 N2O4(g)达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数
[? ]
A.不变
B.增大
C.减小
D.无法判断
参考答案:C
本题解析:
本题难度:一般
5、选择题 下面关于化学反应的限度的叙述中,不正确的是( )
A.任何可逆反应都有一定的限度
B.化学反应达到限度时,正逆反应速率相等
C.化学反应的限度可以通过改变条件而改变
D.当一个化学反应在一定条件下达到限度时,反应即停止
参考答案:A.可逆反应不可能完全转化,反应物的转化率不可能达到100%,所以任何可逆反应都有一定的限度,故A正确;
B.当化学反应达到反应限度时,即达到平衡状态,正逆反应速率相等,故B正确;
C.化学反应限度是在一定条件下的平衡状态,当外界条件发生改变时,正逆反应速率不相等,则平衡发生移动,即化学反应的限度可以通过改变条件而改变,故C正确;
D.当化学反应达到反应限度时,正逆反应速率相等,但反应没有停止,故D错误.
故选D.
本题解析:
本题难度:简单
| 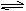 4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表:
4NH3(g)+ 3O2(g),进一步研究生成量与温度的关系,常压下测得部分数据如下表:
