| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《物质组成与性质实验方案的设计》试题预测(2017年最新版)(二)
 若选用试剂①③,则应选择的装置是___________(填代号,下同);推测发生反应的化学方程式为__________________________________________________; 若选用试剂①②,则宜选择的装置是____________。 (5)方法一中,灼烧时发生反应的化学反应方程式为________________________ ;已知称取黄铁矿样品的质量为1.50g,称得灼烧后固体的质量为0.8g,不考虑操作误差,则该矿石中FeS2的质量分数是________________。 参考答案:(16分,每空2分) 本题解析:略 本题难度:一般 3、实验题 (15分)以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。 |
参考答案:(1)坩埚钳、酒精灯(可以不答“火柴”)
(2)步骤②有错误?应先将试样研细,后放入坩埚称重
(3)因硫酸钠放置在空气中冷却时,会吸空气中的水分
(4)保证试样脱水完全
(5)B、D、F
本题解析:(1)从给出的实验用品和实验步骤中不难发现缺少的实验用品有酒精灯和坩埚钳。
(2)实验步骤中存在的错误是第②步中将称量过的试样由坩埚中放到研细,再放回到坩埚中,必有试样残存在研钵中,这会增大实验误差。改正的方法是将样品先研细、再称量。
(3)硫酸钠不能放置在空气中冷却的原因是空气中含有水蒸气,冷却过程中会使硫酸钠重新结合水分,变成水合物,给实验测定造成误差。
(4)步骤⑤的目的是使晶体完全失去结晶水,减小实验误差。
(5)造成测定结果偏高的原因是晶体减少的质量超过实验中结晶水的质量。B、D、F符合题目要求。
本题难度:一般
4、实验题 (10分) (1)某研究性学习小组对“钠在空气中燃烧的产物”进行了探究。其实验过程是:取一小块钠在空气中加热片刻后与一定量的水反应,收集到VmL气体(标准状况),向所得溶液中滴入1.000mol/L的盐酸溶液30.00mL恰好中和完全(如图所示)。试回答: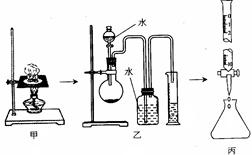
①甲、乙、丙三套装置共有________处错误。
②丙的操作中,若以酚酞作指示剂,滴定终点时锥形瓶内溶液颜色变化是?。
③若V=168mL(标准状况),在一定条件下将其引燃,恰好完全反应。请将钠块在空气中加热片刻后所得到的固体成分及其质量填表如下:(表格可不填满也可补充)
| 成分 | ? | ? | ? |
| 质量/g | ? | ? | ? |
 __(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。
__(填“大”、“小”、“相同”),否则不能用这种指示剂。如用AgNO3溶液滴定溶液中的Cl-的含量时常以CrO42-为指示剂,这是因为AgCl比Ag2CrO4更____溶的缘故。参考答案:(1)①三?②浅红色或红色变成无色,且在半分钟不褪色
③
成分
Na2O
Na
Na2O2
质量/g
0.31g
0.23g
0.39g
本题解析:略
本题难度:一般
5、简答题 胆矾CuSO4?5H2O是一种蓝色晶体,用它进行以下几个实验:①取少量晶体,用研钵研碎后,放入硬质玻璃管中,加热,可以看到晶体颜色逐渐变成白色,同时试管口有水珠生成;②冷却后,取试管内少量白色粉末,用蒸馏水溶解,又得到蓝色溶液.③将此溶液分置于A、B两支试管中;④向A试管中滴入NaOH溶液后,可观察到有蓝色沉淀生成;⑤将一枚无锈铁钉放入B试管中,片刻后,取出铁钉,铁钉表面附着一层红色物质.请用化学方程式表示上述变化,并指出所发生的反应的类型.
(1)加热胆矾晶体:______,______;
(2)A试管中反应:______,______;
(3)B试管中反应:______,______.
参考答案:(1)CuSO4?5H2O不稳定,加热分解生成CuSO4和H2O,反应的方程式为CuSO4?5H2O△.CuSO4+5H2O↑,
故答案为:CuSO4?5H2O△.CuSO4+5H2O↑;分解反应;
(2)蓝色沉淀为Cu(OH)2,CuSO4和NaOH发生复分解反应生成Cu(OH)2和Na2SO4,反应的方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,
故答案为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;复分解反应;
(3)铁钉表面附着一层红色物质,应为Cu,说明Fe比Cu活泼,可发生置换反应,方程式为CuSO4+Fe=FeSO4+Cu,
故答案为:CuSO4+Fe=FeSO4+Cu;置换反应.
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《钠及其化合.. | |