微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1∶3,则与溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为(? )
A.21∶5
B.11∶3
C.4∶1
D.3∶1
参考答案:C
本题解析:根据电子得失守恒,假设ClO-为1mol,ClO3-为3mol,共失去电子为1+3×5=16mol;故被氧化的为1+3=4mol,被还原的为16mol,故答案选C。
本题难度:一般
2、选择题 在反应8NH3+3Cl2=N2+6NH4Cl中,被还原物质与被氧化物质分子数之比[? ]
A.8∶3
B.3∶8
C.3∶2
D.1∶3
参考答案:C
本题解析:根据方程式可知,氨气中氮元素的化合价从-3价,升高到0价,失去3个电子。氯气中氯元素的化合价从0价降低到-1价,得到1个电子,所以根据电子的得失守恒可知,被还原物质与被氧化物质分子数之比3∶2,答案选C。
点评:该题是基础性试题的考查,试题注重基础,侧重能力的培养。该题的关键是准确标出有关元素的化合价变化情况,然后依据电子的得失守恒直接列式计算即可,有利于培养学生的应试能力。
本题难度:一般
3、填空题 实验室可用KMnO4固体和浓盐酸反应制氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O。
(1)该反应中氧化剂是_____________,还原剂是__________________。
(2)若反应中有0.20 mol 电子发生转移,生成氯气的体积为?(标准状况),被氧化的HCl的物质的量是?。
参考答案:(1) KMnO4 ,? HCl?;(2)2.24L? , 0.20 mol。
本题解析:在反应2KMnO4+16HCl(浓) ="==" 2KCl+2MnCl2+5Cl2↑+8H2O中,化合价的变化: Mn由KMnO4中的+7价——MnCl2是+2价,化合价降低,得到电子,被还原,发生还原反应,作氧化剂;Cl由HCl的-1价——Cl2的0价,化合价升高,失去电子,被氧化,反应氧化反应,作还原剂。产生5molCl2,转移电子10mol。若转移电子0.20mol,则产生氯气为0.1mol,在标准状况下体积为2.24L。这时被氧化的HCl的物质的量为0.20mol。
本题难度:一般
4、选择题 工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A.反应①和②均为氧化还原反应
B.反应①的氧化剂是O2,还原剂是FeO·Cr2O3
C.Na2Cr2O7中Cr元素的化合价为+7
D.反应①中生成1 mol的Na2CrO4时共转移28 mol电子
参考答案:B
本题解析:反应②中元素无化合价的变化,A项错误;Na2Cr2O7中Cr的化合价为+6价,C项错误;从反应①看该反应转移电子数为28 mol,故生成1 mol Na2CrO4转移电子数为3.5 mol,D项错误。
本题难度:一般
5、填空题 (7分)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl 、ClO
、ClO 、
、 ;三种含氯元素的离子,其中C1O
;三种含氯元素的离子,其中C1O 、
、 两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
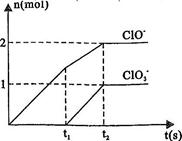
(1)t1前,氧化产物是??(填化学式)。
(2)t2时,Ca(OH)2与Cl2发生反应的总的离子方程式为:?
(3)该石灰乳中含有Ca(OH)2的物质的量是?mol
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是?(填字母)。
A.NaCl、Cl2
B.NaCl、NaClO
C.NaClO3、NaClO4
D.NaCl、NaClO3
 +?OH
+?OH ————?
————?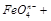 ?
?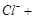 ?
?