微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 已知X、Y、Z、W、N是短周期元素中的四种元素,它们的原子序数依次增大.X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍,工业上常用电解w与N的化合物来制备N单质。
(1)请写出Z在元素周期表中的位置________?。化合物甲由元素X与Z组成,1mol甲含18mol电子,请写出甲的电子式:?;
(2)元素N的一种常见的可溶性盐溶液呈碱性,其原因是(用离子方程式表示):?;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,其离子方程式为?。
(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与NaOH溶液反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。写出加热条件下乙与过量NaOH溶液反应的离子方程式?。
(5)乙溶液中所有离子的浓度等式表达式为?。
参考答案:(1)第二周期,第∨A族?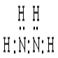 ?(2)AlO2-+2H2O
?(2)AlO2-+2H2O Al(OH)3+OH-
Al(OH)3+OH-
(3)3Cu + 2NO3— + 8H+ = 3Cu2+ + 2NO↑ + 4H2O?
(4)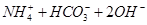

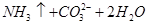 ?
?
(5)c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
本题解析:质子就是H+,X为H;Y最外层电子数是内层电子数的2倍可知Y为C;工业上采用电解法制备的物质一般是K、Ca、Na、Mg、Al,所以W为O、N为Al,则Z为N。(1)N位于元素周期表第二周期VA族,N和H形成18电子分子为N2H4。(2)含铝元素的呈碱性的盐溶液一般是偏铝酸盐。(3)H、C、N、O中三种元素组成强酸为硝酸,铜与稀硝酸生成硝酸铜、一氧化氮和水。(4)H、C、N、O四种元素组成既能与盐酸又能与氢氧化钠溶液反应的物质可能是碳酸铵或碳酸氢铵或氨基酸,由乙与过量浓氢氧化钠溶液反应生成1mol气体可知乙为碳酸氢铵,碳酸氢铵与过量氢氧化钠溶液加热条件下生成碳酸钠、氨气和水。(5)碳酸氢铵溶液中含有NH4+、H+、HCO3-、CO32-、OH-,根据电荷守恒即可得出答案。
点评:工业上电解熔融氯化钠或熔融氢氧化钠制钠、电解熔融氯化镁制镁、电解熔融氧化铝制铝。
本题难度:一般
2、选择题 能说明Cl的非金属性比S的非金属性强的事实是
A.Cl2与H2反应生成HCl,而S与H2反应生成H2S
B.Cl2与铁反应生成FeCl3,而S与铁反应生成FeS
C.Cl2能与水反应,而S不与水反应
D.Cl原子最外层电子数为7,而S原子最外层电子数为6
参考答案:B
本题解析:略
本题难度:一般
3、选择题 X、Y都是短周期元素,若X的原子序数为n,X2+与Y2-具有相同的电子层结构,则Y的原子序数是:(?)
A.n-2
B.n-4
C.n-6
D.n-8
参考答案:B
本题解析:略
本题难度:简单
4、选择题 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知
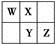
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性大于Y
D.Z元素单质在化学反应中只表现氧化性
参考答案:A
本题解析:根据W的气态氢化物可与其最高价含氧酸反应生成离子化合物,则推出W应为N,所以X为O、Y为S、Z为Cl。A项,H2O、H2S、HCl中稳定性最弱的是H2S,正确。B项,Cl的氧化物对应的水化物有HClO、HClO2、HClO3、HClO4,S的氧化物对应的水化物有H2SO3、H2SO4,错误。C项,O2-的还原性小于S2-的还原性,错误。D项,Cl2在化学反应中既可以表现氧化性,又可以表现还原性,如Cl2和NaOH的反应,错误。
本题难度:一般
5、选择题 A 和 B 是同周期的相邻元素, B 和 C 是同主族的相邻元素,且A、B、C 最外层电子数之和为 19,则A、B、C三种元素分别是?(?)
A.N、 F、 Cl? B.F、 O 、S? C.S、 Cl 、O? D.S 、O 、F
参考答案:B
本题解析:考查元素周期表的结构。本题可以采用排除法,A中N和F不相邻。C中Cl和O不是同主族的,D中O和F也不是同主族的,所以正确的答案是B。
本题难度:一般