微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.下表列出了①~⑨九种元素在周期表中的位置.
族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0
2
④
⑤
⑥
⑦
⑨
3
①
②
③
⑧
|
请回答:
(1)画出元素⑨的原子结构示意图______.
(2)九种元素中非金属性最强的是______(填元素符号).
(3)①、②两种元素原子半径比较:①______②(填“<”或“>”).在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是______(填化学式).
(4)⑦、⑧两种元素组成的氢化物的热稳定性比较:⑦______⑧(填“<”或“>”).
(5)元素⑤对应的氢化物的化学式是______,其水溶液的pH______7(填“<”或“>”).④、⑤两种元素对应的最高价含氧酸的酸性强的是______(填化学式).
(6)①、⑥两元素形成的化合物的电子式为______,该化合物是由______(填“共价键”“离子键”)键形成的.
参考答案:根据元素在周期表中的分布情况,可以确定①是Na,②是Mg,③是Al,④是C,⑤是N,⑥是O,⑦是F,⑧是Cl,⑨是Ne.
(1)Ne原子的结构示意图为:
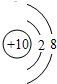
,故答案为:
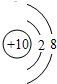
;
(2)同周期元素的原子从左到右非金属性逐渐增强,同一主族元素的原子从下到上非金属性逐渐增强,所以非金属性最强的元素在右上角,即为F,故答案为:F;
(3)根据元素周期律:同周期元素原子半径从左到右逐渐减小,所以原子半径Na>Mg,最高价氧化物对应水化物的碱性逐渐增强,所以碱性:NaOH>Mg(OH)2>Al(OH)3,
故答案为:>;?NaOH;
(4)根据元素周期律:同主族元素从上到下氢化物的稳定性逐渐减弱,所以稳定性HF>HCl,故答案为:>;
(5)元素N对应的氢化物的化学式是NH3,其水溶液氨水是弱碱,显碱性,它的pH>7,C、N两种元素对应的最高价含氧酸的酸性:硝酸>碳酸,故答案为:NH3;>;HNO3;
(6)Na、O两元素形成的化合物为氧化钠,氧化钠是氧离子和钠离子间通过离子键形成的离子化合物,它的电子式为

,
故答案为:

;离子.
本题解析:
本题难度:一般
2、推断题 有A、B、C、D、E5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是______,B是____,C是______,D是______,E是______。(填名称)
(2)由这五种元素组成的一种化合物是(写化学式)____ 。写出该物质的一种主要用途____________。
(3)写出C元素基态原子的电子排布式____________。
(4)用轨道表示式表示D元素原子的价电子构型____________。
参考答案:(1)氢;氧;铝;硫;钾
(2)KAl(SO4)2·12H2O;净水剂
(3)1s22s22p63s23p1(4)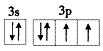
本题解析:
本题难度:一般
3、填空题 A、B、C、D四种均为短周期元素,原子序数依次增大
(1)A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M,M可以使溴水褪色。
(2)A元素的单质和C元素的单质化合可生成Z, Z在加热条件下跟水反应的产物1 mol需用3mol KOH才能完全中和。
(3)A元素的单质和B元素的单质一定条件下反应生成化合物N,D元素的单质和B元素的单质反应生成化合物G,化合物N和化合物G的相对分子质量相等,且焰色反应均呈黄色。
回答下列问题:
(1)画出元素D的离子结构示意图:_____________;
(2)A、B、C、D四种元素的原子半径按由小到大排列的顺序为(用相应的元素符号表示):_________________________________
(3)M可以使溴水褪色,写出该反应的离子方程式___________;
(4)Z与热水反应的化学方程式____________。
(5)化合物N与化合物G的水溶液反应,若氧化剂与还原剂物质的量之比为1:1,该反应的离子方程式为__________
(6)常温下,D的氢化物呈气态,有毒,水溶液呈酸性。脱除天然气中D的氢化物既能减少环境污染,又可回收D的单质。用过量NaOH溶液吸收D的氢化物后,以石墨作电极电解该溶液可回收D的单质,其电解总反应的化学方程式(忽略溶解氧的氧化还原反应)为__________ ;该方法的优点是_______________ _____ 。
参考答案:(1)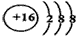
(2)O<S <P< Na
(3)H2SO3 + Br2 + H2O = 4H+ + SO42- + 2Br-?
(4)P2O5+3H2O(热)=2H3PO4
(5)Na2O2 + S2- + 2H2O = 2Na+ + S + 4OH-
(6)Na2S + 2H2O  S↓+ H2↑+ 2NaOH
S↓+ H2↑+ 2NaOH
生成的NaOH可循环利用,副产氢气可以作为化工原料或燃料
本题解析:
本题难度:一般
4、选择题 下列说法错误的是
A.离子的核外电子层数不一定等于该元素所在的周期数
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.除氦外的稀有气体的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
参考答案:D
本题解析:同位素的化学性质相同,物理性质不相同.
本题难度:困难
5、选择题 碱性强弱介于KOH和Mg(OH)2之间的氢氧化物( )
A.NaOH
B.Al(OH)3
C.LiOH
D.RbOH
参考答案:Li、Na、K、Rb处于同主族,原子序数增大,则金属性Rb>K>Na>Li,
Na、Mg、Al处于同周期,原子序数增大,则金属性Na>Mg>Al,
故Na的金属性介于K、Mg之间,即NaOH的碱性介于KOH和Mg(OH)2之间,
故选A.
本题解析:
本题难度:简单