微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.Li、Na、K原子的电子层数依次增多,最高正价依次升高
B.Si、P、S、Cl的原子序数依次增大,最低负价依次降低
C.Li、Be、B、C的最外层电子数依次增多,最高正价依次升高
D.所有的元素都有0价和负价,但是不一定有正价
参考答案:C
本题解析:逐项分析.
A.错误.Li、Na、K原子的电子层数分别为2、3、4,电子层数依次增多是正确的;但它们的最外层电子数都为1,最高正价都为+1,最高正价依次升高是错误的.
B.错误.Si、P、S、Cl的原子序数分别为4、5、6、7,原子序数依次增大是正确的;但其最低负价分别为-4、-3、-2、-1,-4<-3<-2<-1,由-4到-1化合价逐渐升高,最低负价依次降低是错误的.
C.正确.Li、Be、B、C的最外层电子数分别为1、2、3、4,最外层电子数依次增多是正确的,它们的最高正价分别为+1、+2、+3、+4,最高正价依次升高也是正确的.
D.错误.所有的元素都有0价,但是不一定有正价(如F元素);金属没有负价,故所有的元素都有负价是错误的.
本题难度:困难
2、选择题 下列叙述不正确的是( )
A.Na、Mg、Al元素最高化合价依次升高
B.P、S、Cl元素与氢气化合逐渐变易
C.N、O、F元素非金属性依次减弱
D.Li、Na、K原子的电子层数依次增多
参考答案:C
本题解析:
本题难度:一般
3、选择题 科学家们预测原子序数为114的元素具有相当稳定的同位素,它的位置在第七周期ⅣA族.关于它的推测错误的是
A.它的金属性比铅强
B.它是不活泼的非金属
C.它的原子最外层电子数为4
D.它的原子半径比铅大
参考答案:B
本题解析:
本题难度:简单
4、填空题 X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示,若X、Y、Z的核外电子数之和为31,填写下列空白: X、Y、Z、W的元素名称分别为:
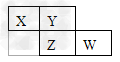
X__________,Y__________,Z_____________,W____________.
参考答案:氮 ;氧 ;硫 ;氯
本题解析:
本题难度:一般
5、简答题 下表标出的是元素周期表的一部分元素,回答下列问题
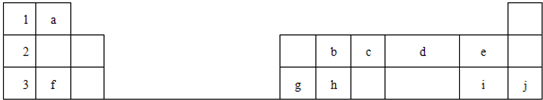
(1)表中列出的10种元素中,化学性质最不活泼的是______(填元素名称,下同),非金属性最强的是______,原子半径最小的是______.
(2)分子bd2的电子式______,元素e的负一价阴离子的结构示意图______.
(3)物质bd2和hd2在物理性质上有着巨大差异,其原因是物质bd2属于______晶体,物质hd2属于______晶体.
(4)元素e的气态氢化物比元素i的气态氢化物______(填“稳定”或“不稳定”)
(5)元素f、g的最高价氧化物对应水化物之间反应的离子方程式是______;
(6)物质fda含有的化学键类型是______.
参考答案:根据元素在周期表中的分布知识,可以确定a是H,b是C,c是N,d是O,e是F,f是Na,g是Al,h是Si,i是Cl,j是Ar.
(1)表中列出的10种元素中,稀有气体元素Ar化学性质稳定,同一周期,元素原子半径从左到右半径在减小,同一主族元素的原子半径从上到下逐渐增大;所以原子半径最小的是H,同周期元素的原子从左到右,元素的非金属性逐渐增强,同一主族,元素的原子从上到下,元素的非金属性逐渐减弱,所以费金属性最强的是F,故答案为:氩;氟;氢;
(2)二氧化碳是碳原子和氧原子之间通过共价双键形成的共价化合物,电子式为:
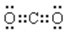
,氟离子核外电子数为10,离子的结构示意图为:
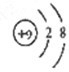
,故答案为:
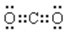
;

;
(3)二氧化碳是分子晶体,二氧化硅是原子晶体,分子晶体的熔点低于原子晶体,故答案为:分子;原子;
(4)同主族元素的原子,从上到下氢化物越来越稳定,所以元素F的气态氢化物比元素Cl的气态氢化物稳定,故答案为:稳定;
(5)元素f的最高价氧化物对应水化物是氢氧化钠,g的最高价氧化物对应水化物是氢氧化铝,氢氧化铝是两性氢氧化物,能和强碱反应,实质是:Al(OH)3+OH-=[Al(OH)4]-,故答案为:Al(OH)3+OH-=[Al(OH)4]-;
(6)氢氧化钠中钠离子和氢氧根之间是离子键,氧和氢之间是共价键,故答案为:离子键和共价键.
本题解析:
本题难度:一般