微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 理论上可用于设计成原电池的化学反应都是放热反应,下列可设计成原电池的是( )
A.NaOH+HCl=NaCl+H2O
B.Ba(OH)2?8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
C.CaO+H2O=Ca(OH)2
D.CH4+2O2=CO2+2H2O
参考答案:A、属于中和反应,是放热反应,但不是氧化还原反应,不能设计成原电池,故A错误;
B、属于复分解反应,是吸热反应,不是氧化还原反应,不能设计成原电池,故B错误;
C、属于化合反应,是放热反应,但不是氧化还原反应,不能设计成原电池,故C错误;
D、是放热反应,且是氧化还原反应,能设计成原电池,可以设计成甲烷燃料电池,故D正确.
故选D.
本题解析:
本题难度:简单
2、填空题 低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g) + H2O(g) H2(g) + CO2(g)的平衡常数随温度的变化如下表:
H2(g) + CO2(g)的平衡常数随温度的变化如下表:
请回答下列问题:
(1)上述正反应方向是?反应(填“放热”或“吸热”)。
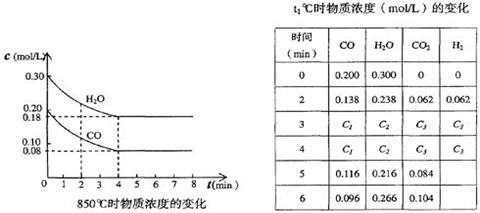
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)。
t1℃时物质浓度(mol/L)的变化
时?间(min)
| CO
| H2O
| CO2
| H2
|
0
| 0.200
| 0.300
| 0
| 0
|
2
| 0.138
| 0.238
| 0.062
| 0.062
|
3
| C1
| C2
| C3
| C3
|
4
| C1
| C2
| C3
| C3
|
5
| 0.116
| 0.216
| 0.084
| ?
|
6
| 0.096
| 0.266
| 0.104
| ?
|
(3) t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_____状态;C1数值_____0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是____(单选),表中5 min~6 min之间数值发生变化,可能的原因是______(单选)。
A.增加水蒸气? B.降低温度? C.使用催化剂? D.增加氢气浓度
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为:?。
(5)若在850℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO转化率为Y,试推导Y随X变化的函数关系式为?。
(6) 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g)?△H =" +67.7" kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g)?△H = -534.0 kJ·mol-1
NO2(g) 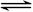 1/2N2O4(g)?△H = -26.35 kJ·mol-1
1/2N2O4(g)?△H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
________________________________________________________。
参考答案:(1)放热?(2分)(2)0.03 (2分)?
(3)①平衡?大于(每空1分)?② D? A(每空1分)
(4)75%?(2分)?(5)Y=X(2分)
(6)2N2H4(g) + N2O4(g)=3N2(g) + 4H2O(g)?△H = -1083.0 kJ·mol-1(3分)
本题解析:(1)根据表中数据可知,随着温度的升高,平衡常数逐渐减小,说明升高温度,平衡向逆反应方向移动,因此正反应是放热反应。
(2)根据图像可知,在0~4 minCO的浓度减少了0.2mol/L-0.08mol/L=0.12mol/L,所以反应速率是0.12mol/L÷4min=0.03mol/(L·min)。
(3)①在3 min~4 min之间,物质的浓度不再发生变化,所以反应达到平衡状态。由于正反应是放热反应,所以升高温度,平衡向逆反应方向移动,因此平衡时C1大于0.08 mol/L。
②增大水蒸气的浓度或降低温度平衡都向正反应方向移动,催化剂不能影响平衡状态,增大氢气浓度平衡向逆反应方向移动,D正确;5min~6min时,CO的浓度降低,水蒸气和氢气的浓度增大,所以平衡向正反应方向移动,因此改变的条件是增大水蒸气的浓度,答案选A。
(4)? CO(g) + H2O(g) H2(g) + CO2(g)
H2(g) + CO2(g)
起始量(mol)?(5-5X)? 5X? 0? 0
转化量(mol)?(5-5X)Y (5-5X)Y?(5-5X)Y (5-5X)Y
平衡量(mol)(5-5X-5Y+5XY)(5X-5Y+5XY)?(5-5X)Y (5-5X)Y
所以有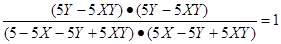
解得Y=X
所以CO的转化率是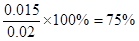
(5)? CO(g) + H2O(g) H2(g) + CO2(g)
H2(g) + CO2(g)
起始浓度(mol/L)? 0.020? 0.020? 0? 0
转化浓度(mol/L)? x? x? x? x
平衡浓度(mol/L)? 0.02-x? 0.02-x? x? x
(6)考查盖斯定律的应用。根据已知反应可知,②×2-①-③×2即得到2N2H4(g) + N2O4(g)=3N2(g) + 4H2O(g) ,所以反应热△H=-534.0 kJ·mol-1×2-67.7 kJ·mol-1+26.35 kJ·mol-1×2=-1083.0 kJ·mol-1。
本题难度:一般
3、选择题 下列有关原电池的说法不正确的是
A.锌锰干电池中锌电极是负极,工作时锌被还原
B.锌与稀硫酸反应时,加入少量硫酸铜溶液可使反应加快
C.燃料电池的电极本身不包含活性物质,其燃料和氧化剂由外部供给
D.判断一种电池的优劣主要看其比能量、比功率以及可储存时间的长短
参考答案:A
本题解析:原电池中较活泼的金属作负极,失去电子,被氧化发生氧化反应,选项A是错误的。B中锌可以把铜离子置换出来,生成铜单质,和锌构成原电池,加快反应速率。所以答案选A。
本题难度:一般
4、选择题 下列关于铜、锌和稀硫酸构成的原电池说法正确的是
A.锌是正极,铜是负极
B.电子经导线有锌流向铜
C.电流沿导线有锌流向铜
D.H+在溶液中向锌片移动
参考答案:B
本题解析:本题考查铜锌原电池的原理
由铜锌和稀硫酸组成的原电池,正极是铜,负极是锌,所以A错;
正极发生还原反应,电极反应是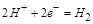 ,则溶液中
,则溶液中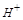 H+向铜片移动,故D错;
H+向铜片移动,故D错;
负极发生的是氧化反应,电极反应是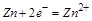 ,电子的流动方向是从锌以导线流向铜,故B正确;
,电子的流动方向是从锌以导线流向铜,故B正确;
电流的方向与电子流动的方向相反,由铜流向锌,故C错
所以本题正确答案为B
本题难度:一般
5、选择题 日常所用的干电池的电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2氧化吸收
H2),电极反应可简化为:Zn-2e-=Zn2+;2NH4++2e-=2NH3+H2,根据上述叙述判断下列说法正确的是
[? ]
A.干电池中锌为正极,碳为负极
B.干电池工作时,电子由锌极经外电路流向碳极
C.干电池长时间连续工作时,内装糊状物可能流出腐蚀用电器
D.干电池可实现化学能向电能的转化和电能向化学能的转化
参考答案:BC
本题解析:
本题难度:一般