|
高考化学知识点总结《原电池原理》在线测试(2017年最新版)(六)
2017-08-01 00:49:08
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据如图所示的装置,判断下列说法正确的是( )
A.该装置中a极为负极
B.当装置中某一块铜片的质量变化了12.8?g时,a极上消耗的O2在标准状况下的体积为4.48?L
C.该装置中b极的电极反应式是:H2-2e-=2H+
D.一段时间后,左边装置中溶液pH减小
| 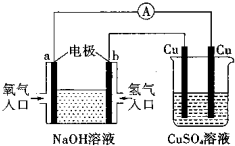
参考答案:A.由图可知,左端为燃料电池,通入氢气的一极为电源的负极,即b为负极,故A错误;
B.由2Cu~4e-~O2↑,某一块铜片的质量变化了12.8?g时,n(Cu)=12.8g64g/mol=0.2mol,所以a极上消耗的O2在标准状况下的体积为0.1mol×22.4L/mol=2.24L,故B错误;
C.氢氧燃料电池中,通入氧气的b极为原电池的正极,发生得电子得还原反应,即2H2O+4e-+O2=4OH-,故C错误;
D.氢氧燃料电池反应产物是水,NaOH溶液的浓度变小,则pH减小,故D正确;
故选D.
本题解析:
本题难度:一般
2、选择题 一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是
[? ]
A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e-=2H2O(1)
C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e-
D.O2(g)+2H2O(1)+4e-=4OH-
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列有关电能和原电池的说法中不正确的是( )
A.电能是应用最广泛、使用最方便、污染最小的一种二次能源
B.目前,在我国发电总量的构成中火力发电居于首位
C.燃料电池是一种高效、环境友好的发电装置
D.充电电池的放电反应与充电反应互为可逆反应
参考答案:A、一次能源经过加工、转换得到的能源为二次能源,电能对环境无污染,所以电能是应用最广泛、使用最方便、污染最小的一种二次能源,故A正确;
B、我国火力发电占总发电量的81.2%,所以在我国发电总量的构成中火力发电居于首位,故B正确;
C、燃料电池可以直接将贮存在燃料与氧化剂中的化学能转化为电能,所以燃料电池是一种高效、环境友好的发电装置,故C正确;
D、放电过程是原电池,是自发的氧化还原反应;而充电过程是电解池,是非自发的氧化还原反应,是用电流强迫电解质溶液在两极发生氧化还原反应,因为条件不一样,所以它们是不可逆的,故D错误.
故选D.
本题解析:
本题难度:一般
4、填空题 (8分)给你提供纯锌、纯铜片和500mL0.2mol·L-1的H2SO4溶液、导线、1000mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。
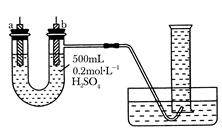
(1)如图所示,装置气密性良好,且1000mL量筒中已充满了水,则开始实验时,首先要______________________________________。
(2)a电极材料为__________,其电极反应式为______________________。
b电极材料为__________,其电极反应式为__________________。
(3)当量筒中收集到672mL气体时(已折算到标准状况下),通过导线的电子的物质的量为________。
参考答案:(8分) (1)用导线把a、b两电极连接起来
(2)纯锌片 Zn-2e-===Zn2+?纯铜片 2H++2e-===H2↑
(3)0.06mol
本题解析:本题主要考查了锌铜原电池的相关内容。锌片做为负极,失电子,溶液中的氢离子在铜片上得电子生成氢气。
只需把两极用导线连接起来形成闭合回路,即可形成原电池。
由2e-~H2↑很容易求出导线中通过的电子的物质的量为0.06mol
本题难度:一般
5、选择题 &n bsp;甲醇燃料电池被认为是21世纪电动汽车的最佳候选动力源,其工作原理如图所示。下列有关叙述正确的是? ( )。
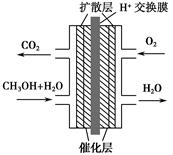
A.通氧气的一极为负极
B.H+从正极区通过交换膜移向负极区
C.通甲醇的一极的电极反应式为CH3OH+H2O-6e-=CO2↑+6H+
D.甲醇在正极发生反应,电子经过外电路流向负极
参考答案:C
本题解析:外电路中电子从负极流向正极,内电路H+从负极移向正极,B、D错误;O2在正极发生还原反应,A错误;甲醇在负极发生氧化反应,负极反应式为CH3OH+H2O-6e-=CO2↑+6H+。
本题难度:一般
| 