微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)18g重水2H2O中含氢原子______个,含电子数为______个.
(2)在无土栽培中,配制只含0.5mol/LNH4+、0.6mol/L?Cl-、0.5mol/L?K+、______mol/L?SO42-的某营养液,若用KCl、(NH4)2?SO4、______配制1L该营养液,则需这三种固体的物质的量分别为?0.5mol、0.2mol、______mol.
参考答案:(1)18g重水2H2O的物质的量为18g20g/mol=0.9mol,由化学式2H2O可知,n(H)=0.9mol×2=1.8mol,故含有H原子数目为1.8mol×NAmol-1=1.8NA;
每个2H2O分子含有10个电子,电子物质的量是水分子的10倍,故n(电子)=0.9mol×10=9mol,故含有电子数目为9mol×NAmol-1=9NA,
故答案为:1.8NA,9NA;
(2)根据溶液中电荷守恒可知,溶液中c(NH4+)+c(K+)=c(Cl-)+2c(SO42-),所以0.5mol/L+0.5mol/L=0.6mol/L+2c(SO42-),故c(SO42-)=0.2mol/L;
1L溶液中n(NH4+)=1L×0.5mol/L=0.5mol,n(Cl-)=1L×0.6mol/L=0.6mol,n(K+)=1L×0.5mol/L=0.5mol,n(SO42-)=1L×0.2mol/L=0.2mol.0.5molKCl中含有n′(K+)=0.5mol,n′(Cl-)=0.5mol,0.2mol(NH4)2?SO4中含有的n′(NH4+)=0.4mol,n′(SO42-)=0.2mol,故还缺少0.1molNH4+、0.1molCl-,故还需要0.1molNH4Cl,
故答案为:0.2,NH4Cl,0.1.
本题解析:
本题难度:一般
2、计算题 计算题:
(Ⅰ).(6分)标准状况下,22.4LHCl气体溶于50ml水后再配成250m1溶液。
(1) 计算HCI的物质的量?
(2)计算所得盐酸的物质的量浓度?
(Ⅱ)(6分)某种待测浓度的H2SO4溶液5mL,加入10mL0.5mol/LBaCl2溶液,恰好完全反应。问得到BaSO4沉淀多少克?
参考答案:(1)1m0L(3分)
(2)4m0l/L。(3分)
(Ⅱ)得到BaSO4沉淀1.165克。
本题解析:标准状况下,22.4LHCl气体的物质的量: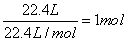
22.4LHCl气体溶于50ml水后再配成250m1溶液,所得盐酸的物质的量浓度:
(Ⅱ)解:依题意,设得到BaSO4沉淀x,则
n(BaCl2) = 0.01L×0.5mol/L =" 0.005" mol?2分
H2SO4 +? BaCl2 =? BaSO4↓ + 2HCl?2分
1 mol? 233g
0.005 mol? x
∴ x =" 1.165" g? 2分
答:得到BaSO4沉淀1.165克。
点评:考查物质的量计算及其相应的推导公式计算,计算简单,重在格式的书写及计算的精确考查。
本题难度:一般
3、实验题 有下列化学仪器:
①托盘天平;②玻璃棒;③药匙;④烧杯; ⑤量筒;⑥容量瓶;⑦胶头滴管;⑧细口试剂瓶;⑨标签纸。
(1)现需要配制500 mL、1 mol·L-1硫酸溶液,需用质量分数为98%、密度为1.84 g·cm-3的浓硫酸____mL。
(2)从上述仪器中,按实验使用的先后顺序,其编号排列是____ 。
(3)容量瓶使用前检验漏水的方法是____。
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)。
①用以稀释浓硫酸的烧杯未洗涤____。
②未经冷却时趁热将溶液注入容量瓶中____。
③摇匀后发现液面低于刻度线再加水____。
④容量瓶中原有少量蒸馏水____。
⑤定容时俯视刻度线____。
参考答案:(1)27.2
(2)⑤④②⑥⑦⑧⑨
(3)往容量瓶内加适量水,塞好瓶塞,用食指顶住瓶塞,用另一只手的五指托住瓶底,把瓶倒立过来,如不漏水,把瓶塞旋转180°后 塞紧,再把瓶倒立过来,若不漏水,才能使用
(4)①偏低②偏高③偏低④无影响⑤偏高
本题解析:
本题难度:一般
4、选择题 在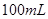
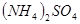 和
和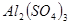 的混合溶液中,加入足量的
的混合溶液中,加入足量的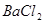 的溶液,生成
的溶液,生成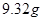 沉淀,再加入足量
沉淀,再加入足量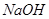 溶液并加热,生成
溶液并加热,生成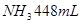 (标准状况),则原溶液中
(标准状况),则原溶液中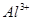 的浓度为
的浓度为
A.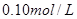
B.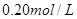
C.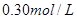
D.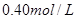
参考答案:B
本题解析:9.32g沉淀是硫酸钡,物质的量是9.32g÷233g/mol=0.04mol,所以SO42-的物质的量是0.04mol。氨气是0.448L÷22.4L/mol=0.02mol,则NH4+的物质的量是0.02mol。因此根据电荷守恒可知,溶液中Al3+的浓度是(0.04mol×2-0.02mol)÷3=0.02mol,因此浓度是0.02ml÷0.1L=0.2molL,答案选B。
本题难度:一般
5、选择题 将0.1mol Cu与40ml 10mol/LHNO3充分反应,测得反应后的溶液里含有a molH+
由此可知?
A.生成的气体一定是NO2,在标准状况下的体积4.48 L
B.生成的气体一定是NO,在标准状况下的体积约1.49L
C.被还原的硝酸的物质的量为(0.2-a)mol
D.反应后的溶液里含有0.2mol NO3-
参考答案:C
本题解析:略
本题难度:一般