微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 由氢气和氧气反应生成1mol水蒸气放出241.8kJ的热量,1g水蒸气转化为液态水放出2.45kJ的热量,则下列热化学方程式书写正确的是( )
A.H2(g)+ O2(g)=H2O(l);△H=-285.9kJ/mol
O2(g)=H2O(l);△H=-285.9kJ/mol
B.H2(g)+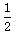 O2(g)=H2O(l);△H=-241.8kJ/mol
O2(g)=H2O(l);△H=-241.8kJ/mol
C.H2(g)+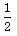 O2(g)=H2O(l);△H=+285.9kJ/mol
O2(g)=H2O(l);△H=+285.9kJ/mol
D.H2(g)+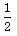 O2(g)=H2O(l);△H=+241.8kJ/mol
O2(g)=H2O(l);△H=+241.8kJ/mol
参考答案:A
本题解析:
本题难度:简单
2、填空题 常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ.mol-1)下表是一些键能数据(kJ·mol-1)
化学键
| 键能
| 化学键
| 键能
| 化学键
| 键能
|
C-F
| 427
| C-Cl
| 330
| C-I
| 218
|
H-H
| 436
| S=S
| 255
| H-S
| 339
|
回答下列问题:
(1)由表中数据规律预测C-Br键的键能范围:_________ <C-Br键能<__________ (回答数值和单位)
(2)热化学方程式2H2(g)+S2(g) =2H2S(g);△H= QkJ·mol-1;则Q=
(3) 已知下列热化学方程式:
O2 (g) = O+2(g) + e—  H1=" +1175.7" kJ·mol-1
H1=" +1175.7" kJ·mol-1
PtF6(g) + e—= PtF6—(g)  H2= —771.1 kJ·mol-1
H2= —771.1 kJ·mol-1
O2+PtF6—(s) = O2+(g) + PtF6—(g) 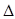 H3=" +482.2" kJ·mol-1
H3=" +482.2" kJ·mol-1
则反应O2(g) + (g) = O2+PtF6— (s)  H="_____________" kJ·mol-1。
H="_____________" kJ·mol-1。
参考答案:(1)218 KJ·mol-1 ~330 KJ·mol-1 (2)—229 (3)PtF6;—77.6
本题解析:(1)根据表中数据得规律:卤族元素C-X键的键能由上到下依次减小,预测C-Br键的键能范围:218 KJ·mol-1<C-Br键能<330 KJ·mol-1;(2)根据化学反应的焓变等于反应物的键能之和减生成物的键能之和计算,注意各物质的结构和化学键的数目;
△H="2×436" KJ·mol-1 +255KJ·mol-1 —4×339KJ·mol-1=—229 kJ·mol-1;
(3)依据盖斯定律①+②-③得到,反应热化学方程式为:O2(g)+PtF6(g)
本题难度:困难
3、简答题 现已确认,CO、SO2和NOx的排放是造成大气污染的重要原因.
(1)用CO2和氢气合成CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机.已知CH3OH具有重要意义,既可以解决环境问题,还可解决能源危机.已知CH3OH、H2的燃烧热分别为-726.5kJ/mol、-285.8kJ/mol,写出工业上用CO2和H2合成CH3OH的热化学方程式:______.
(2)用铂作电极,一极通入空气,一极通入CH3OH(l),与KOH溶液可组成燃料电池,其负极反应式为______.溶液中的阴离子向______极定向移动.
(3)如图是一个电化学装置示意图,用CH3OH-空气燃料电池作此装置的电源.
①如果A为粗铜,B为纯铜,C为CuSO4溶液.该原理的工业生产意义是______.
②如果A是铂电极,B是石墨电极,C是AgNO3溶液.通电后,若B极增重10.8g,该燃料电池理论上消耗______mol甲醇.(计算
结果保留两位有效数字)
(4)常温下向1L、0.2mol/L?NaOH溶液中通入4.48L(标准状况)的SO2(忽略混合后溶液体积的变化),若测得溶液的pH<7,则溶液中c(SO32-)_______c(H2SO3)(填“>”、“<”、或“=”).有关该溶液中离子浓度关系的判断正确的是______(填字母编号).
A.c(SO32-)十c(OH-)+c(HSO3-)=c(Na+)+c(H+)
B.c(H2SO3)+c(HSO3-)+c(SO32-)=0.2mol/L
C.c(H2SO3)+c(H+)=c(SO32-)十c(OH-)
D.c(Na+)>c(H+)>c(HSO3-)>c(OH-)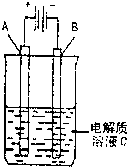
参考答案:(1)甲醇和氢气的燃烧热书写其热化学方程式分别为:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l),△H1=-1453kJ/mol;
②2H2(g)+O2(g)=2H2O(l),△H2=-571.6KJ/mol,
根据盖斯定律,反应CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
可以看成是方程式32×②-①×12,所以△H=32×(-571.6KJ/mol)-(-1453kJ/mol)×12=-130.9KJ/mol,
故答案为:CO2(g)+3H2(g)═CH3OH(l)+H2O(l),△H=-130.9KJ/mol;
(2)在甲醇燃料电池中,负极上是燃料甲醇失电子的反应,当电解质是KOH溶液时,
电极反应为:CH3OH-6e-+8OH-=6H2O+CO32-,电解质中的阴离子向负极移动,
故答案为:CH3OH-6e-+8OH-=6H2O+CO32-;负;
(3)①如果阳极为粗铜,阴极为纯铜,电解质为CuSO4溶液的电解池可以实现粗铜中金属铜的精炼,即电解精炼金属铜,故答案为:精炼粗铜;
②A是铂电极,B是石墨电极,C是AgNO3溶液.通电后,B极上的电极反应为:Ag++e-=Ag,当质量增重10.8g时,转移电子0.1mol,根据甲醇燃料电池的总反应式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l),可知当转移12mol电子时,消耗甲醇的物质的量为2mol,所以当转移0.1mol电子时,消耗甲醇的物质的量为0.212≈0.017mol,
故答案为:0.017;
(4)常温下向1L、0.2mol/L?NaOH溶液中通入4.48L(标准状况)的SO2(忽略混合后溶液体积的变化)时,所得的溶液为0.2mol/L的亚硫酸氢钠,溶液显酸性,说明亚硫酸氢根的电离程度大于水解程度,A、根据电荷守恒得:2c(SO32-)十c(OH-)+c(HSO3-)=c(Na+)+c(H+),故A错误;
B.根据物料守恒得:c(H2SO3)+c(HSO3-)+c(SO32-)=0.2mol/L,故B正确;
C.根据质子守恒得:c(H2SO3)+c(H+)=c(SO32-)十c(OH-),故C正确;
D.溶液中的离子浓度大小关系为:c(Na+)>c(HSO3-)>c(H+)>c(OH-),故D错误.
故选BC.
本题解析:
本题难度:一般
4、选择题 C(s) + H2O(g) == CO(g) + H2(g); △H=+131.3 KJ/mol。它表示
[? ]
A.碳与水反应吸收131.3 KJ的热量
B.1mol固态焦炭与1mol水蒸气反应产生一氧化碳和氢气,吸收131.3 KJ的热量
C.1mol碳和1mol水反应吸收131.3 KJ的热量
D.固态碳和气态水各1mol反应,放出131.3 KJ的热量
参考答案:C
本题解析:
本题难度:一般
5、选择题 同温同压下,已知下列各反应为放热反应,下列各热化学方程式中△H最大的是
[? ]
A.2A (l)+ B(l )= 2C(g) △H1
B.2A (g)+ B(g)= 2C(g) △H2
C.2A (g)+ B(g)= 2C(l) △H3
D.2A (l)+ B(l)= 2C(l) △H4
参考答案:A
本题解析:
本题难度:简单