微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
(1)若A为固体单质
①D的化学式为______,
②E→C的化学方程式为______
③将C通入某非金属单质的溶液中,可发生氧化还原反应生成两种强酸,试举一例写出化学方程式______.
(2)若A为气体单质
①C→D的化学方程式______
②E→C的离子方程式为______.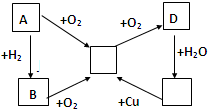
参考答案:A和氧气、氢气反应产物都可以继续和氧气反应,说明A中的元素师变价元素,属于非金属,A+O2→C,C+O2→D,D+H2O→E,证明E为酸,B+O2→C,C+O2→D,E+Cu→C,说明E是强氧化性的酸,结合转化关系分析判断;
(1)若A为固体单质,则判断为S,
①D的化学式为SO3;
②E→C的化学方程式是浓硫酸和铜反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:2H2SO4(浓)+Cu ?△?.?CuSO4+SO2↑+2H2O;
③将二氧化硫通入某非金属单质的溶液中,可发生氧化还原反应生成两种强酸,说明二氧化硫被非金属单质氧化为硫酸,如:Cl2+SO2+2H2O=2HCl+H2SO4;
故答案为:SO3; 2H2SO4(浓)+Cu ?△?.?CuSO4+SO2↑+2H2O;Cl2+SO2+2H2O=2HCl+H2SO4;
(2)若A为气体单质,生成的酸和铜反应,推断为N2,
①C→D的化学方程式为一氧化氮和氧气的反应:2NO+O2=2NO2;
②E→C的离子方程式为稀硝酸和铜反应,离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
故答案为:2NO+O2=2NO2;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
本题解析:
本题难度:一般
2、填空题 (10分)A、B、C、D、E各物质的转化关系如右图所示。
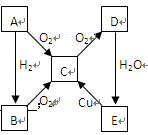
(1)当A为气体单质时,A是?(写化学式)。
写出下列反应的化学方程式,并回答有关问题:
①A→B:?;
②E→C:? ?;
(2)当A为固体单质时,A是?(写化学式)。
写出下列反应的化学方程式:
①C→D:?;
②E与木炭反应:?。
参考答案:(1)N2(1分)
①N2+3H2 2NH3(2分)
2NH3(2分)
②3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O(2分)
(2)S(1分)
①2SO2+O2 2SO3(2分)
2SO3(2分)
②C+2H2SO4 (浓) CO2↑+2SO2↑+2H2O(2分)
CO2↑+2SO2↑+2H2O(2分)
本题解析:本题属于无机框图题。本题的突破点是A、C、D、E这四种物质,因为A C
C D
D E均是通过氧气和水实现的,而能满足这种转换的常见物质有:
E均是通过氧气和水实现的,而能满足这种转换的常见物质有:
①N2 NO
NO NO2
NO2 HNO3;②S
HNO3;②S SO2
SO2 SO3
SO3 H2SO4;
H2SO4;
③NH3 NO
NO NO2
NO2 HNO3;④H2S
HNO3;④H2S SO2
SO2 SO3
SO3 H2SO4;因为A是单质,所以A只能是氮气或硫。
H2SO4;因为A是单质,所以A只能是氮气或硫。
本题难度:一般
3、推断题 下图中A~J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,已知B、D为常温下气态化合物,C为常温下液态化合物,图中有部分生成物未标出。
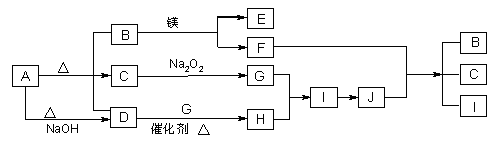
请填写以下空白:
(1)A的化学式?。
(2)写出下列反应的化学方程式:
A→B+C+D _______________________________D→ H?___________________。
I→J? _______________________________________________。
(3)写出在溶液中A+NaOH→D完全反应的离子方程式:______________________________________。
参考答案:(1)NH4HCO3
(2) NH4HCO3 NH3↑+CO2↑+H2O;4NH3+5O2
NH3↑+CO2↑+H2O;4NH3+5O2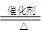 4NO + 6H2O ;3NO2+ H2O=2HNO3+NO
4NO + 6H2O ;3NO2+ H2O=2HNO3+NO
(3)NH4+ + HCO3- +2OH- NH3↑ +CO32- +2H2O
NH3↑ +CO32- +2H2O
本题解析:A受热能分解,分解得到等物质的量的B、C、D,且A与碱反应生成气体D,B、D为常温下气态化合物,C为常温下液态化合物,因此C为水,则A为NH4HCO3。B能与镁反应,则B为CO2,E为MgO,F为C,结合D为NH3,水与过氧化钠反应生成G,G为O2,D与G反应生成H,H为NO,I为NO2,J为HNO3,再结合F与J反应生成B、C、I,符合上述转化。
点评:该题是中等难度的试题,侧重对学生答题能力的培养。利用物质的转化推断出各物质是解答本题的关键,C及A为解答本题的突破口。该类试题需要明确的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
4、推断题 A、B、C、D、E、F、G、H、I是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:
①A、B、E、F、G能使湿润的蓝色石蕊试纸变红,I能使湿润的红色石蕊试纸变蓝,C、D、H不能使湿润的石蕊试纸变色;
②A和I相遇产生白色烟雾;
③B和E都能使品红溶液褪色;
④将红热的铜丝放入装有B的瓶中,瓶内充满棕黄色的烟;
⑤将点燃的镁条放入装有F的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
⑥C和D相遇生成红棕色气体;
⑦G在D中燃烧可以产生E和H2O;
⑧将B和H在瓶中混合后于亮处放置几分钟,瓶内壁出现油状液滴并产生A。
回答下列问题:
(1)A的化学式是____,②中烟雾的化学式是_________;
(2)④中发生反应的化学方程式是____;
(3)⑤中发生反应的化学方程式是____;
(4)C的化学式是____,D的化学式是__________;
(5)⑦中发生反应的化学方程式是____;
(6)H的化学式是____。
参考答案:(1)HCl;NH4Cl
(2)Cu+Cl2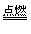 CuCl2
CuCl2
(3)2Mg+CO 2MgO+C
2MgO+C
(4)NO;O2
(5)2H2S+3O2 2SO2+2H2O
2SO2+2H2O
(6)CH4
本题解析:
本题难度:一般
5、简答题 已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)若甲的化学式为RCl3,其溶液在加热蒸干并灼烧时可发生反应:
a.甲+H2O
乙+丙?b.乙氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红棕色粉末,则该金属在周期表中的位置是:______.
②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为:______.
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为______.
(2)若甲,乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲+乙丙.则:
①甲的结构式为______.
②写出上述反应的化学方程式______.
③写出在200mL?2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式______.
参考答案:(1)①甲为三价金属氯化物,常见的只有铝和铁,又因为生成的氯化物为红棕色粉末,所以甲一定为FeCl3,铁位于周期表中第四周期第Ⅷ族,
故答案为:第四周期,第Ⅷ族;
②如果甲为短周期金属元素的氯化物,则只可能为氯化铝;其水解反应式为:AlCl3+3H2O?加热?.?Al(OH)3↓+3HCl↑,故答案为:AlCl3+3H2O?加热?.?Al(OH)3↓+3HCl↑;
③由于在碱性溶液中,只有铝能失电子发生反应而铁不能,所以负极反应式为:Al-3e-+4OH-=AlO2-+2H2O,故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(2)甲、乙、丙为短周期元素,乙为固体单质,甲丙为气体,甲、乙高温下生成丙,且三者均位于同一周期,只可能为C、N、O三元素组成的化合物,综合分析可知:甲为CO2,乙为碳,丙为CO.
①甲为CO2,为直线形分子,结构式为,故答案为:O=C=O;
②反应的方程式为CO2+C?高温?.? 2CO,故答案为:CO2+C?高温?.? 2CO;
③在0.4mol?NaOH溶液中通入0.3mol?CO2,得到的产物既有碳酸钠又有碳酸氢钠,反应的离子方程式为3CO2+4OH-=2HCO3-+CO32-+H2O,
故答案为:3CO2+4OH-=2HCO3-+CO32-+H2O.
本题解析:
本题难度:一般