微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氢能源是一种重要的清洁能源。现有两种可产生H2的固体化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)乙的电子式是__________。
(2)甲可在加热时将二氧化碳还原为甲烷,其化学方程式是?。
(3)乙在加热条件下与CuO反应可生成Cu和气体单质丙,写出该反应的化学方程式?。
(4)甲与乙之间能发生反应产生H2,判断理由是?。
参考答案:(1)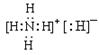
(2)4AlH3+3CO2 3CH4+2Al2O3
3CH4+2Al2O3
(3)2NH4H+5CuO 5Cu+ N2↑+5H2O
5Cu+ N2↑+5H2O
(4)AlH3中氢元素的化合价为-1价,NH4H中含有+1价的氢元素,二者可发生氧化还原反应产生H2。
本题解析:“单质气体丙在标准状态下的密度为1.25 g/L”则丙的相对分子质量=1.25×22.4=28,所以丙为N2。化合物乙分解得到H2和N2,由于乙是固体,所以化合物乙为NH4H,NH4H由NH4+和H—构成的离子化合物。6.00 g化合物甲分解得到短周期元素的金属单质和6.72L÷22.4L/mol=0.3 molH2。根据质量守恒定律可知,该短周期元素的金属单质的质量为6.00g-0.2mol×2g/mol=5.40g;化合物甲与水反应生成的白色沉淀可溶于NaOH溶液,说明该沉淀可能是Al(OH)3,因此该金属元素是铝,所以可判定化合物甲为AlH3。涉及的反应为:a.甲、乙受热分解:2AlH3 2Al+3H2↑? 2NH4H
2Al+3H2↑? 2NH4H N2↑+5H2↑;b.甲与水反应: 2AlH3+6H2O==2Al(OH)3+6H2↑;c. 2NH4H+5CuO
N2↑+5H2↑;b.甲与水反应: 2AlH3+6H2O==2Al(OH)3+6H2↑;c. 2NH4H+5CuO 5Cu+ N2↑+5H2O。
5Cu+ N2↑+5H2O。
(1)化合物乙为NH4H,NH4H由NH4+和H—构成的离子化合物,其电子式为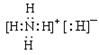 。
。
(2)AlH3可在加热时将二氧化碳还原为甲烷,则根据原子守恒可知,另外一种生成物应该是氧化铝,所以其化学方程式是4AlH3+3CO2 3CH4+2Al2O3。
3CH4+2Al2O3。
(3)NH4H在加热条件下与CuO反应可生成Cu和气体单质氮气,因此根据原子守恒可知,还有水生成,所以该反应的化学方程式 2NH4H+5CuO 5Cu+ N2↑+5H2O。
5Cu+ N2↑+5H2O。
(4)由于AlH3中氢元素的化合价为-1价,—1价H还原性很强,NH4H中含有+1价的氢元素,具有氧化性,所以二者可发生氧化还原反应产生H2。
本题难度:一般
2、选择题 能实现下列物质间直接转化的元素是( )
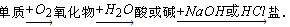
A.硅
B.硫
C.铜
D.铁
参考答案:B
本题解析:
本题难度:简单
3、选择题 若E、M、G、Q四种物质中,其中两种为单质,两种为化合物,通过E+M→G+Q反应,Q不可能是
A.Fe3 04
B.F2
C.A1203
D.C
参考答案:B
本题解析:略
本题难度:一般
4、填空题 (14分)下图中A—J分别代表有关反应中的一种单质或化合物,其中B、C、D、I均为无色气体。(部分产物和反应条件已略去)
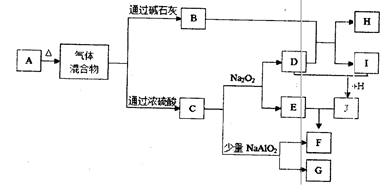
(1)若A加热后得到等物质的量的B和C,则A的化学式为?。
(2)实验室检验B的方法是?。
(3)写出上述由I生成J的化学方程式?。
(4)写出C和少量NaAlO2溶液反应的离子方程式?。
(5)由H所含的两种元素组成的18电子微粒的电子式为?。
(6)若实验室要制备纯净的物质C(可含水蒸气)所需试剂最好选择?(填代号);
A.石灰石?B.稀HNO3?C.稀H2SO4?D.稀HCl? E.纯碱
所需气体发生装置是?(填代号);所选装置中涉及到的玻璃仪器的名称为?。
参考答案:

本题解析:略
本题难度:一般
5、填空题 如图所示,各项变化的未知物焰色的反应均为黄色,E为淡黄色粉末,据此回答下列问题:

(1)写A→E的化学方程式,标出电子转移的方向和数目。
(2)写出C→D的离子方程式。
(3)在B→C的变化中,所得C的溶液往往不纯,其中的杂质(不包括水)可能是?,主要原因是?,还可能是?,主要原因是?。
参考答案:(1)
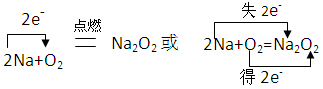
(2)CO32-+2H+=CO2↑+H2O
(3)NaOH?通入CO2不足? NaHCO3?通入CO2过量
本题解析:考查钠及其化合物的转化
由各物质的焰色的反应均为黄色可判定各物质为钠或钠的化合物,E为淡黄色粉末,可确定为Na2O2;
A点燃可得到Na2O2,可知A为钠单质;
Na2O2与水反应得到B:2Na2O2+2H2O=4NaOH+O2↑,与HCl反应得到D:2Na2O2+4HCl=4NaCl+2H2O+O2↑
B(NaOH)与CO2反应生成碳酸钠,即C:2NaOH+CO2=NaCO3+H2O;C与CO2和水生成碳酸氢钠,即F:Na2CO3+CO2+H2O=2NaHCO3
(1)
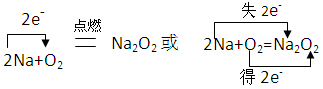
(2)CO32-+2H+=CO2↑+H2O
(3)向NaOH中通入CO2时,气体的量与碱的比例不同时,可得到不同的物质;
当酸性气体不足时,NaOH过量;当气体过量时,有NaHCO3生成:Na2CO3+CO2+H2O=2NaHCO。
本题难度:一般