微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 由分别与Ne和Ar原子具有相同的电子层结构的离子所形成的化合物是( )
A.CaO
B.MgBr2
C.NaF
D.NaCl
参考答案:AD
本题解析:
本题难度:简单
2、选择题 下列有关物质结构的表述正确的是
[? ]
A.次氯酸的电子式 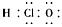
B.二氧化硅的分子式 SiO2
C.硫原子的最外层电子排布式 3s23p4
D.钠离子的结构示意图 
参考答案:C
本题解析:
本题难度:简单
3、简答题 卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.
(1)基态溴原子的电子排布式为______.
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近.Cl2、BrI、ICl沸点由高到低的顺序为______.
(3)气态氟化氢中存在二聚分子(HF)2,这是由于______.
(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的实际空间构型为______.
(5)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是______.
(6)在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为______.
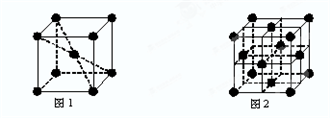
参考答案:(1)溴的原子的质子数为35,核外电子数为35,由核外电子排布规律可知其电子排布式为1s22s22p63s23p63d104s24p5;
故答案为:1s22s22p63s23p63d104s24p5;
(2)因相对分子质量BrI>ICl>Cl2 ,则范德华力BrI>ICl>Cl2 ,即沸点BrI>ICl>Cl2 .
故答案为:BrI>ICl>Cl2.
(3)因F的电负性最大,则HF分子中存在氢键形成二聚分子.
故答案为:HF分子间形成氢键;
(4)中心I原子的价层电子对数为=7+1×2-12=4,价层电子对为正四面体,中心I原子的孤电子对数为7-1×2-12=2,则I3+的空间构型为V形;
故答案为:V形;
(5)KCl晶体中钾离子、氯离子半径都大于镁离子、氧离子半径,镁离子、氧离子所带的电荷多,故MgO中离子键更强,故MgO的熔点更高;
故答案为:MgO;
(6)根据图1可知Fe原子的配位数为8,图2中Fe原子的配位数为12,故图1和图2的结构中铁原子的配位数之比为8:12=2:3;
故答案为:2:3.
本题解析:
本题难度:一般
4、选择题 下列叙述中正确的是( )
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.两原子,如果核外电子排布相同,则一定属于同种元素
D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列各项表述中与示意图一致的是( )
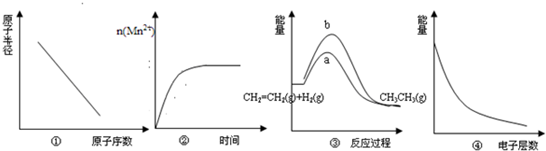
A.图①表示IA族元素原子半径的变化规律
B.图②表示10mL0.01mol?L-1KMnO4酸性溶液与过量的0.1mol?L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化
C.图③中a、b曲线分别表示反应:CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0在使用和未使用催化剂时,反应过程中的能量变化
D.图④表示核外电子能量与电子层数的关系
参考答案:A.IA族元素随原子序数的增大,原子半径在增大,则曲线应为上升趋势,与图象不符,故A错误;
B.n(Mn2+)开始为0,随反应的发生,增大,氧化还原反应结束后,其物质的量不再变化,与图象一致,故B正确;
C.催化剂降低反应所需的活化能,反应的始态、终态相同,曲线a为使用催化剂的情况,与图象一致,故C正确;
D.一般电子层数越多,最外层电子的能量越高,图象中电子层多的能量低,二者不一致,故D错误;
故选BC.
本题解析:
本题难度:简单