微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
(1)电解质溶液为稀H2SO4时,灯泡______(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题).
a.若灯泡亮,则Mg电极上发生的反应为:______;Al电极上发生的反应为:______.
b.若灯泡不亮,其理由为:.
(2)电解质溶液为NaOH(aq)时,灯泡______(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题).
a.若灯泡亮,则Mg电极上发生的反应为:______;Al电极上发生的反应为:______.
b.若灯泡不亮,其理由为:.
参考答案:(1)金属镁和铝为电极材料,电解质溶液为稀H2SO4时,可形成原电池,金属镁较铝活泼,做原电池的负极,铝做原电池的正极,负极反应为Mg-2e-=Mg2+,
正极反应为2H++2e-=H2↑,此时灯泡变亮,故答案为:亮;Mg-2e-=Mg2+;2H++2e-=H2↑;
(2)金属镁和铝为电极材料,电解质溶液为稀NaOH时,由于金属铝能与氢氧化钠溶液反应生成偏铝酸钠溶液和氢气,所以铝为负极,镁为正极,
负极反应为2Al-6e-+8OH-=2AlO2+4H2O,正极反应为6H2O+6e-=3H2+6OH-,形成原电池时,灯泡变亮,
故答案为:亮;6H2O+6e-=3H2+6OH-;2Al-6e-+8OH-=2AlO2+4H2O.
本题解析:
本题难度:一般
2、填空题 (每空2分,共10分)依据事实,填空:
(1)已知某条件下可发生如下反应CH3-CH3→CH2=CH2+H2,有关化学键的键能如下:
化学键
| C-H
| C=C
| C-C
| H-H
|
键能(kJ/mol)
| 414.4
| 615.3
| 347.4
| 435.3
|
则该反应的热化学方程式右边的ΔH= ;
(2)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应式:正极: ;负极:
(3)某核素AZX的氯化物XCl2 1.11 g配成溶液后,需用1mol·L-1的硝酸银溶液20 ml才能把氯离子完全沉淀下来。则X的质量数为 ;
(4) 将甲烷和氧气的混合气体充入含有23.4 g Na2O2的密闭容器中,保持容器中温度为150 ℃,用电火花引燃充分反应后,压强为0 Pa,若将残留物溶于水,无气体逸出。此过程的总反应方程式为 。
参考答案:(1)+125.6kJ·mol-1 (2)O2+2H2O+4e-==4OH- 2H2+4OH--4e-==4H2O
(3) 40 (4) 6Na2O2+2CH4+O2=2Na2CO3+8NaOH
本题解析:(1)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,即该反应的反应热是414.4 kJ/mol×6+347.4 kJ/mol-615.3 kJ/mol-414.4 kJ/mol×2-435.3 kJ/mol=+125.6 kJ/mol。
(2)在原电池中负极失去电子,发生氧化反应,正极得到电子,发生还原反应,所以氢氧燃料电池中氢气在负极通入,氧气在正极通入。又因为电解质是氢氧化钾,所以电极反应式分别是负极:2H2+4OH--4e-==4H2O、正极:O2+2H2O+4e-==4OH-。
(3)消耗硝酸银是1.0mol/L×0.02L=0.02mol,所以氯化物的物质的量是0.01mol,其相对分子质量是1.11÷0.01=111,所以X的质量数是111-35.5×2=40。
(4)根据题意可知,甲烷、氧气和过氧化钠恰好反应,因此最终的生成物是碳酸钠和氢氧化钠。设甲烷和氧气的物质的量是x和y,因为过氧化钠是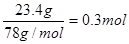 ,所以根据电子得失守恒可知8x=4y+0.3mol×2.根据氢原子守恒可知,氢氧化钠是4x,根据碳原子守恒可知碳酸钠是x。因此根据钠原子守恒可知4x+2x=0.3mol×2,解得x=0.1mol,所以y=0.05,即过氧化钠、甲烷和氧气的物质的量之比是6
,所以根据电子得失守恒可知8x=4y+0.3mol×2.根据氢原子守恒可知,氢氧化钠是4x,根据碳原子守恒可知碳酸钠是x。因此根据钠原子守恒可知4x+2x=0.3mol×2,解得x=0.1mol,所以y=0.05,即过氧化钠、甲烷和氧气的物质的量之比是6
本题难度:困难
3、填空题 利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验用品:电极________、________、稀硫酸、________(填写所缺的实验用品)、耳机(或者电流计)。
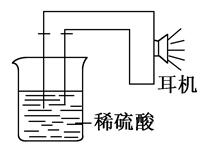
(3)实验装置:
(4)原电池设计及注意的问题。
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓”声音。其原因是:在原电池中,由化学能转化为________。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的______
极,电极反应是________________;另一极应该接电流计的________极,电极发生了________反应(“氧化”或“还原”)。
参考答案:(2)铁钉或铁条 铜钉(其他的惰性电极如铅笔芯、铂等) 烧杯、导线
(4)①电能 ②负 Fe-2e-=Fe2+ 正 还原
本题解析:由实验原理:Fe+2H+=Fe2++H2↑,可知组成该原电池的负极应为Fe,正极可选用活动性比Fe弱的金属或导电的非金属。
本题难度:一般
4、选择题 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是
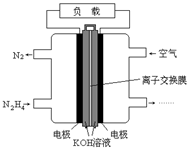
A.电流从右侧电极经过负载后流向左侧电极
B.负极发生的电极反应式为:N2H4 + 4OH- - 4e - = N2+ 4H2O
C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D.该燃料电池持续放电时,正极发生氧化反应,PH减小
参考答案:D
本题解析:燃料电池通入燃料的一极为负极。电流有正极流向负极,A正确;负极反应是N2H4,环境是碱性,产物是N2,故B正确;C项电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触,是正确的。总反应为N2H4 + O2 ="=" N2+ 4H2O,产生水,使KOH溶液浓度降低pH减小,D正确。
本题难度:一般
5、选择题 下图是生活中常用的锌锰干电池的示意图,下列有关说法中不正确的是
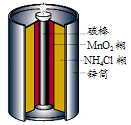
[? ]
A.电池内部含有电解质 ?
B.?锌是负极,碳棒是正极
C.电子由碳棒经外电路流向锌?
D.锌锰干电池属一次电池
参考答案:C
本题解析:
本题难度:一般